
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)<v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率大于80% |
分析 A.结合v=$\frac{△c}{△t}$计算反应在前50 s的平均速率为v(PCl3);
B.由表格数据可知,250s达到平衡,c(PCl3)=$\frac{0.20mol}{2.0L}$=0.1mol/L,则升高温度,平衡时,c(PCl3)=0.11 mol•L-1,可知升高温度平衡正向移动;
C.PCl5(g)?PCl3(g)+Cl2(g)
开始0.5 0 0
转化 0.1 0.1 0.1
平衡 0.4 0.1 0.1
K=$\frac{0.1×0.1}{0.4}$=0.025,
起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,Qc=$\frac{0.1×0.1}{0.5}$=0.02<K;
D.等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,则参加反应的PCl3的物质的量大于1.6mol.
解答 解:A.反应在前50s的平均速率为v(PCl3)=$\frac{\frac{0.16mol}{2L}}{50s}$=0.001 6 mol•L-1•s-1,故A错误;
B.由表格数据可知,250s达到平衡,c(PCl3)=$\frac{0.20mol}{2.0L}$=0.1mol/L,则升高温度,平衡时,c(PCl3)=0.11 mol•L-1,可知升高温度平衡正向移动,则正反应为吸热反应,反应的△H>0,故B错误;
C.PCl5(g)?PCl3(g)+Cl2(g)
开始0.5 0 0
转化 0.1 0.1 0.1
平衡 0.4 0.1 0.1
K=$\frac{0.1×0.1}{0.4}$=0.025,
起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,Qc=$\frac{0.1×0.1}{0.5}$=0.02<K,平衡正向移动,则达到平衡前v(正)>v(逆),故C错误;
D.等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,故达到平衡时,PCl3的转化率高于$\frac{1.6mol}{2mol}$=80%,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,题目难度中等,把握表格中数据应用、化学平衡三段法、速率及K的计算为解答的关键,侧重分析与计算能力的考查.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | 都有气体产生 | B. | 最终产生的气体体积相同 | ||
| C. | ①中一开始就产生气体 | D. | ②中一开始不产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子数目为0.6NA | |
| C. | 标准状况下,2.24LCH3CH2OH含有共价键数为0.8NA | |
| D. | 12.5mL 16 mol•L-1浓硫酸与6.5g锌共热,转移的电子数等于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
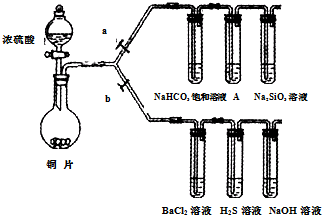
| 滴加的溶液 | 氯 水 | 氨 水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
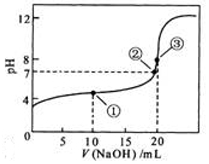 常温下,用 0.1000molL -1NaOH溶液滴定 20.00mL0.1000molL -1CH 3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000molL -1NaOH溶液滴定 20.00mL0.1000molL -1CH 3COOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 滴定过程中可能出现:c (CH 3COO -)>c (Na +)>c (CH 3COOH)>c (H +)>c (OH -) | |
| B. | 点①所示溶液中酸的中和率大于50% | |
| C. | 点②是二者恰好中和点 | |
| D. | 点③所示溶液中:c (Na +)>c (OH -)>c (CH 3COO -)>c (H +) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
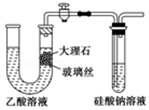
| A. | 使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3) | |
| B. | 用Na2S溶液与AlCl3溶液混合制取Al2S3 | |
| C. | Na2S的水溶液有臭鸡蛋气味,其原因为S2-+2H2O?H2S+2OH- | |
| D. | 实验室保存Na2CO3溶液、水玻璃、NaOH溶液等试剂,必须用带橡胶塞的试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的乙烯通入溴的CCl4溶液中,可观察到红棕色褪去 | |
| B. | 烃的衍生物至少由三种元素组成 | |
| C. | 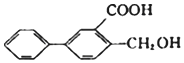 的苯环上的一氯代物有6种(不含立体异构) 的苯环上的一氯代物有6种(不含立体异构) | |
| D. | 己烷有5种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
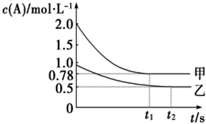 向甲、乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB.相同温度下,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法不正确的是( )
向甲、乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB.相同温度下,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法不正确的是( )| A. | x不可能等于2 | |
| B. | 甲、乙两容器中反应达平衡时,平衡常数K(甲)=K(乙) | |
| C. | 将乙容器升温可使甲、乙容器内各物质的体积分数相同 | |
| D. | 若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78 mol/L<c(A)<1.56 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | t1 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | t2 | K2 |
| A. | T1<T2 | |
| B. | 乙容器中,当反应进行到$\frac{{t}_{2}}{2}$min时,n(H2O)=1.4 mol | |
| C. | K2=1.35 mol•L-1(或K2=1.35) | |
| D. | 混合气体的密度始终保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com