
 2Cu+O2↑+2H2SO4 计算生成的硫酸0.25mol,生成铜0.25mol,将电源反接后,电路中又通过1mol电子,首先发生电镀,
2Cu+O2↑+2H2SO4 计算生成的硫酸0.25mol,生成铜0.25mol,将电源反接后,电路中又通过1mol电子,首先发生电镀, 2Cu+O2↑+2H2SO4 又转移0.5mol电子,再计算生成的硫酸的物质的量,两次之和为硫酸总的物质的量,根据c=
2Cu+O2↑+2H2SO4 又转移0.5mol电子,再计算生成的硫酸的物质的量,两次之和为硫酸总的物质的量,根据c= 计算氢离子浓度.
计算氢离子浓度. 2Cu+O2↑+2H2SO4 转移0.5mol电子,令生成的硫酸的物质的量为xmol,生成的铜为ymol,则:
2Cu+O2↑+2H2SO4 转移0.5mol电子,令生成的硫酸的物质的量为xmol,生成的铜为ymol,则: 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子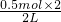 =0.5mol/L.
=0.5mol/L.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
用惰性电极电解2L1.0mol·L-1CuSO4溶液,在电路中通过0.5mol电子后,调换正负极继续电解,电路中又通过了1mo1电子,此时溶液中c(H+)(假设溶液体积不变)为( )
A.1.5mol·L-1 B.0.75mol·L-1
C.0.5mol·L-1 D.0.25mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com