
| A. | 第一电离能介于B、N之间的第二周期元素有1种 | |
| B. | 基态Fe原子的外围电子排布图为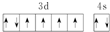 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 |
分析 A.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
B.基态铁原子外围电子排布式为3d64s2,根据洪特规则分析;
C.N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
D.Cu的外围电子排布式为3d104S1,位于元素周期表的ds区.
解答 解:A.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;故A错误;
B.基态铁原子外围电子排布式为3d64s2,根据洪特规则电子总是优先单独占据一个轨道,而且自旋状态相同,则外围电子排布图为: ,故B正确;
,故B正确;
C.N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于氧元素的,故C错误;
D.Cu的外围电子排布式为3d104S1,位于元素周期表的ds区,故D错误;
故选B.
点评 本题考查第一电离以及原子核外电子排布规律及排布式和排布图的书写,题目难度不大,注意同周期元素第一电离能异常情况.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H++HS-,HS-
H++HS-,HS- H++S2-;
H++S2-;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气在常温下是气体,而磷单质是固体 | |
| B. | N2在空气中不能燃烧,而磷能在空气中燃烧 | |
| C. | NH3极易溶于水,而PH3难溶于水 | |
| D. | 硝酸比磷酸酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+m}$(A-Z+m)mol中子 | B. | $\frac{a}{A}$(Z+m)mol电子 | ||
| C. | $\frac{a}{A+m}$(Z+m)mol质子 | D. | $\frac{a}{A}$mmol HmX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 溴单质与水的反应比氯单质与水的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
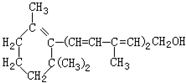
| A. | 维生素A的分子式为C16H25O | |
| B. | 维生素A含有苯环结构 | |
| C. | 维生素A的一个分子中有3个双键 | |
| D. | 维生素A的分子中含有两种官能团 (维生素A的结构简式) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
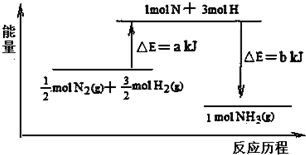
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com