
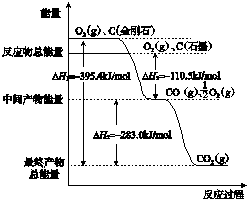
分析 (1)①物质能量越高,物质越不稳定;燃烧热是在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,依据图象判断石墨的燃烧热;
②根据图示,写出热化学方程式:C(石墨)+O2(g)=CO2(g)△H=-393.5KJ/mol ①
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol ②
根据盖斯定律来分析;
(2)①依据所给的热化学方程式,根据目标反应,将已知热化学方程式进行变形得到目标反应,反应热也做相应的变化即可;
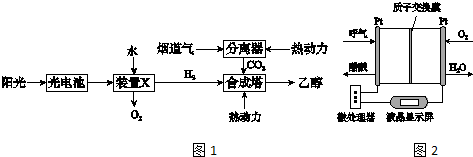
②A.该流程至少包含太阳能转化为电能,电能转化为化学能,化学能转化为热能和动能等
B.装置X中是电解水生成氧气的反应,是电解池;
C.合成塔中生成乙醇的反应不是化合反应;
D.过程中利用阳能转化为电能,电能转化为化学能,化学能转化为热能和动能等,流程设计体现了绿色化学思想;
③由装置图可知酒精在负极被氧气氧化发生氧化反应生成醋酸.
解答 解:(1)①图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为△H=-393.5kJ?mol-1;
故答案为:石墨;-393.5kJ?mol-1;
②根据图示,可知热化学方程式:C(S、石墨)+O2(g)=CO2(g)△H=-393.5KJ/mol ①
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol ②
根据盖斯定律,将①-②×2可得:C(s、石墨)+CO2(g)═2CO(g);△H=+172.5 kJ•mol-1,故答案为:C(s、石墨)+CO2(g)═2CO(g);△H=+172.5 kJ•mol-1;
(2)已知:①a、H2O(l)=H2O(g)△H=+44kJ•mol-1
b、CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
c、2CO(g)+4H2 (g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1
依据盖斯定律c-b×2-3a得到:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=-305.7kJ•mol-1 ;
故答案为:-305.7kJ•mol-1 ;
②A.该流程至少包含太阳能转化为电能,电能转化为化学能,化学能转化为热能和动能等,该流程至少包含4种形式的能量转化,故A正确;
B.装置X中是由水生成氧气的反应,是电解反应,即是电解池,故B错误;
C.2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l),反应可知合成塔中生成乙醇的反应不是化合反应,故C错误;
D.过程中利用阳能转化为电能,电能转化为化学能,化学能转化为热能和动能等,流程设计体现了绿色化学思想,故D正确;
故答案为:AD;
③由装置图可知酒精在负极被氧气氧化发生氧化反应生成醋酸,负极反应为CH3CH2OH-4e-+H2O=4H++CH3COOH,故答案为:CH3CH2OH-4e-+H2O=4H++CH3COOH.
点评 本题考查了化学反应能量变化,原电池、电解池原理分析应用,热化学方程式、电解反应方程式的书写式解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 晶体 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质R |
| 熔点 | 810℃ | 710℃ | 180℃ | -70℃ | 2300℃ |
| 沸点 | 1465℃ | 1418℃ | 177.8℃ | 57℃ | 2500℃ |
| A. | SiCl4是分子晶体 | |
| B. | MgCl2中键的强度比NaCl中键的强度小 | |
| C. | 单质R可能是原子晶体 | |
| D. | AlCl3为离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na在足量O2中燃烧,消耗1mol O2时转移的电子数是4×6.02×1023 | |
| B. | 标准状况下,6.72L NO2与水分子充分反应转移的电子数目为0.1NA | |
| C. | 盐酸和醋酸的混合溶液pH=1,该溶液中c(H+)=0.1 mol/L | |
| D. | 1 L 0.1 mol/L NH4Cl溶液中的NH4+数是0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | HBr的电子式为H+(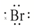 )- )- | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X位于元素周期表中第2周期ⅤA族 | |
| B. | X元素有-3、+5两种化合价 | |
| C. | X元素在元素周期表中的族序数肯定为奇数 | |
| D. | X元素最高价氧化物对应的水化物可以表示为H3XO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3OH+3O2→2CO2+4H2O | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Zn+2HCl=ZnCl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,逆反应速率增大,正反应速率减小 | |
| B. | 恒温时,增大压强,CO浓度不变 | |
| C. | 该反应的化学方程式为:CO2+H2?CO+H2O | |
| D. | 该反应的焓变为负值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
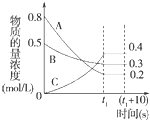 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题: 2C.
2C.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com