
| A. | pH=7的溶液 | B. | c(H+)=c(OH)=10-6mol/L溶液 | ||
| C. | 使酚酞试液呈无色的溶液 | D. | 任何盐溶液 |
分析 溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,当溶液中:c(H+)>c(OH-),溶液呈酸性;c(H+)=c(OH-),溶液呈中性;c(H+)<c(OH-),溶液呈碱性;常温下,水的离子积Kw=1×10-14,所以,pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性.Kw受温度影响,水的电离是吸热反应,温度越高Kw越大,据此进行判断.
解答 解:A、pH=7的溶液,不一定是常温下,水的离子积不一定是Kw=1×10-14,溶液中c(H+)、c(OH-)不一定相等,故A错误;
B、溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,溶液中氢离子浓度大于氢氧根离子浓度,溶液一定显示中性,故B正确;
C、酚酞的变色范围是8-10,酚酞显示无色,溶液有可能显示碱性,故C错误;
D、酸式盐中的硫酸氢钠先酸性,碳酸钠显碱性,故D错误;故选:B.
点评 本题考查溶液酸碱性的判断,明确溶液的酸碱性取决于溶液中c(OH-)、c(H+)的相对大小是解本题关键,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 300mL3.5 mol/L KCl溶液 | B. | 1000mL2.5mol/L NaCl溶液 | ||
| C. | 250mL1 mol/L AlCl3溶液 | D. | 200mL2mol/L MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
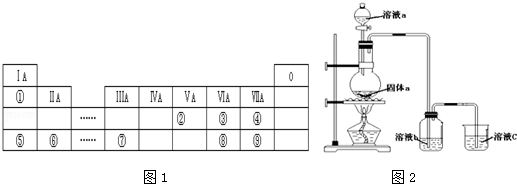
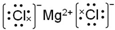 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 随着反应的进行,逆反应速率逐渐增大,最后不变 | |
| D. | 达到化学平衡状态时,SO2和SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
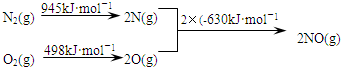
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
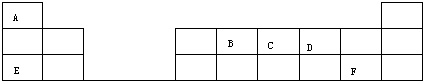
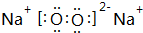 F的原子结构示意图为
F的原子结构示意图为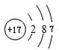 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH+)+c(HCO2-)+c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)+c(NH3.H2O)<0.1mol.L-1 | |
| D. | 向③、④中分别加入25mL0.1mol.L-1盐酸后,溶液中c(NH4+):③<④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类、油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 多饮用纯净水,少饮用矿泉水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com