
| A. | 含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为NA | |
| B. | 标准状况下,22.4 L O2 作氧化剂时转移电子数一定为4NA | |
| C. | 10 L 0.1 mol/L 的Na2CO3溶液中,Na+、CO32-总数为3NA | |
| D. | 通常状况下,4.2 g丙烯中所含碳氢键数目为0.6 NA |
分析 A.铜只能与浓硫酸反应,与稀硫酸不反应;
B.根据氧元素的价态有-1价和-2价来分析;
C.碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子;
D.丙烯的最简式为CH2,根据最简式进行计算含有H原子的物质的量,从而得出形成碳氢键的物质的量.
解答 解:A.含1 mol H2SO4的浓硫酸与足量铜反应,随着反应进行,浓硫酸浓度降低,不再与铜反应,所以转移的电子总数小于NA,故A错误;
B.氧元素的价态有-1价和-2价,1molO2作氧化剂后如果被还原为-1价,则转移2mol电子,若被还原为-2价,则转移4mol电子,故B错误;
C.碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,10 L 0.1 mol/L 的Na2CO3溶液中,Na+、CO32-总数大于3NA,故C错误;
D.4.2 g丙烯含有$\frac{4.2g}{14g/mol}$×2×NA=0.6 NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意盐类的水解,题目难度不大.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:解答题
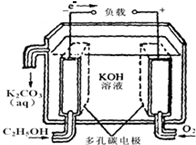 (1)广州是一座美丽的海滨城市,海水资源非常丰富.海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3,下列说法正确的是bc(填写序号字母);
(1)广州是一座美丽的海滨城市,海水资源非常丰富.海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3,下列说法正确的是bc(填写序号字母);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持容器体积不变,充入1molSO3(g) | |
| B. | 保持容器内压强不变,充入1molSO3(g) | |
| C. | 保持容器体积不变,充入1molO2(g) | |
| D. | 保持容器内压强不变,充入1molAr(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用铜作电极电解硫酸溶液:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| C. | 等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合时发生反应:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 某烷烃命名为3-甲基-5-乙基己烷一定是错误的 | |
| B. | 用溴的CCl4溶液可鉴别己烷、2,4-己二烯和甲苯 | |
| C. | 酸性条件下CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 1 mol八溴醚分子(结构如图)充分水解最多消耗8 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
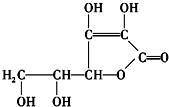
| A. | 维生素C能使溴水褪色 | B. | 维生素C不能与碘单质反应 | ||
| C. | 维生素C可发生水解反应 | D. | 维生素C是较强的还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器I、II中正反应速率相同 | |
| B. | 容器I、III中反应的平衡常数相同 | |
| C. | 容器I中CO 的物质的量比容器II中的少 | |
| D. | 容器I中CO 的转化率与容器II中CO2 的转化率之和小于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂中的每一种元素在反应中都得到电子 | |
| B. | 还原剂在同一反应中既可以是反应物,也可以是生成物 | |
| C. | 失电子多的还原剂,还原性不一定强 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com