
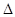 H=��67.7 kJ��mol-1
H=��67.7 kJ��mol-1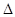 H=��57.3 kJ��mol-1
H=��57.3 kJ��mol-1A�������ĵ��뷽��ʽ����ЧӦ�ɱ�ʾΪ��HF(aq) F-(aq)+H+(aq)�� F-(aq)+H+(aq)��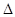 H=��10.4 kJ��mol-1 H=��10.4 kJ��mol-1 |
| B����V=20ʱ����Һ�У�c(OH-)=c(HF)+c(H+) |
| C����V=20ʱ����Һ�У�c(F-)��c(Na+)=0.1 mol��L-1 |
| D����V��0ʱ����Һ��һ�����ڣ�c(Na+)��c(F-)��c(OH-)��c(H+) |
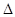 H=��10.4 kJ��mol-1��A��
H=��10.4 kJ��mol-1��A��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g) ��H="-Q" kJ��mol-1(Q��0)�����SO2��ת����Ϊ90%��
2SO3(g) ��H="-Q" kJ��mol-1(Q��0)�����SO2��ת����Ϊ90%��| A��1.8Q kJ | B��2Q kJ | C��Q kJ | D��0.9 QJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��
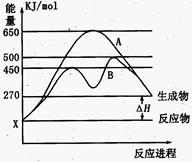
�� ��Ӧ�����������仯������ͼ������ͼ���ж�������������ȷ����
��Ӧ�����������仯������ͼ������ͼ���ж�������������ȷ����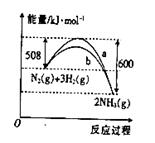
A���÷�Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+3H2(g) 2NH3(g)��H=+92kJ/mol 2NH3(g)��H=+92kJ/mol |
B�� �����Ǽ������ʱ�������仯���� �����Ǽ������ʱ�������仯���� |
| C������������û�ѧ��Ӧ�ķ�Ӧ����ֵ���С |
D����Ӧ2NH3(g)  N2(g)+3H2(g) ��H=+92kJ/mol N2(g)+3H2(g) ��H=+92kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
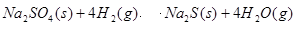 �÷�Ӧ��ƽ�ⳣ������ʽΪ ��
�÷�Ӧ��ƽ�ⳣ������ʽΪ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����67.7 kJ��mol��1 | B����43.5 kJ��mol��1 |
| C����43.5 kJ��mol��1 | D����67.7 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
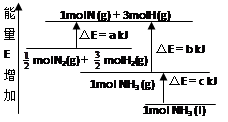
| A��N2(g)+3H2(g)��2NH3(1)�� ��H��2(a-b-c)kJ��mol��1 |
| B��N2(g)+3H2(g)��2NH3(g)����H��2(b-a)kJ��mol��1 |
C��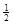 N2(g)+ N2(g)+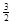 H2(g)��NH3(1)����H��(b+c-a)kJ��mol��1 H2(g)��NH3(1)����H��(b+c-a)kJ��mol��1 |
D��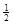 N2(g)+ N2(g)+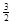 H2(g)��NH3(g)�� ��H��(a+b)kJ��mol H2(g)��NH3(g)�� ��H��(a+b)kJ��mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2 + O2 = 2H2O��H= -571.6KJ/mol |
| B��H2��g��+ 1/2O2��g��= H2O (l)��H= -142.9KJ/mol |
| C��H2��g��+ 1/2O2��g��= H2O (l)��H= -285.8KJ/mol |
| D��2H2��g��+ O2��g�� = 2H2O ��g����H=" -571.6KJ/mol" |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��KOH(aq) + 1/2 H2SO4(aq) = 1/2K2SO4(aq) + H2O(l)����H ����11.46kJ/mol |
| B��2KOH(s) + H2SO4(aq) = K2SO4(aq) + 2H2O(l)����H ����114.6kJ/mol |
| C��2KOH(aq) + H2SO4 =K2SO4(aq) + H2O(l)����H ����114.6kJ/mol |
| D��KOH (aq) + 1/2 H2SO4(aq) = 1/2K2SO4(aq) + H2O(l)����H ����57.3kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com