
| A. | 400 | B. | 500 | C. | 4×10-4 | D. | 2.5×10-3 |
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3的水解:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用石墨作电解电解氯化镁溶液:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2OH-+H2↑+Cl2↑ | |
| C. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-?2Fe2++I2+3H2O | |
| D. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
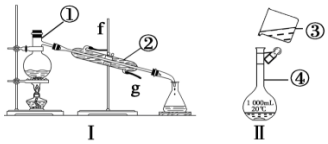
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素符号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的单质的还原性逐渐增强 | |
| B. | 在RCl2分子中,各原子最外层均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所得的化合物中有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某盐溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| B. | 某溶液中加入硝酸银溶液时,产生白色沉淀,说明原溶液中含有Cl- | |
| C. | 用铂丝蘸取某溶液在酒精灯上灼烧时,火焰呈黄色,说明原溶液中一定含有NaCl | |
| D. | 某溶液中加入BaCl2溶液生成白色沉淀,说明原溶液中有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
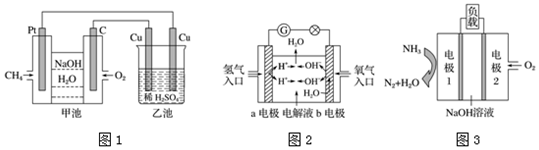
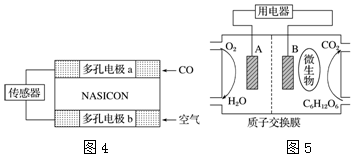
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、H2S、H2Te分子间作用力依次增大 | |
| B. | 金刚石是碳原子间以共价键相结合的原子晶体,加热熔化时需破坏共价键 | |
| C. | 氢氧化钙和氯化铵固体加热制氨气过程中,均有离子键和共价键的断裂和生成 | |
| D. | SiO2和CO2中每个原子的最外层都具有8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
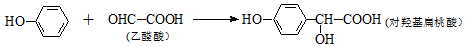
| A. | 上述反应的原子利用率可达100% | |
| B. | 上述反应类型为取代反应 | |
| C. | 对羟基扁桃酸可发生加成反应、取代反应和缩聚反应 | |
| D. | 1 mol对羟基扁桃酸与足量NaOH溶液反应,最多可消耗3 mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com