
ΓΨΧβΡΩΓΩ![]() ΨΏ”–ΗΤν―Ωσ–ΆΫαΙΙΘ§“ρΨΏ”–”≈“λΒΡΒγΦΪΜ·ΧΊ–‘ΓΔΧζ¥≈–‘ΓΔΖ«¥≈Ψχ‘Β–‘Β»Εχ±Η ήΙΊΉΔΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
ΨΏ”–ΗΤν―Ωσ–ΆΫαΙΙΘ§“ρΨΏ”–”≈“λΒΡΒγΦΪΜ·ΧΊ–‘ΓΔΧζ¥≈–‘ΓΔΖ«¥≈Ψχ‘Β–‘Β»Εχ±Η ήΙΊΉΔΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
![]() œ¬Ν–F‘≠Ή”ΙλΒά±μ¥ο ΫΥυ±μ ΨΒΡΉ¥Χ§Θ§ΡήΝΩ”…ΗΏΒΫΒΆΒΡΥ≥–ρ’ΐ»ΖΒΡ «_______
œ¬Ν–F‘≠Ή”ΙλΒά±μ¥ο ΫΥυ±μ ΨΒΡΉ¥Χ§Θ§ΡήΝΩ”…ΗΏΒΫΒΆΒΡΥ≥–ρ’ΐ»ΖΒΡ «_______![]() Χν―ΓœνΉ÷ΡΗ
Χν―ΓœνΉ÷ΡΗ![]() ΓΘ
ΓΘ
![]()
A.![]()
![]()
![]()
![]()
![]() œύΆ§―Ι«Ωœ¬Θ§HFΓΔHClΓΔHBrΒΡΖ–Βψ”…ΗΏΒΫΒΆΒΡΥ≥–ρΈΣ_________Θ§‘≠“ρΈΣ_______ΓΘ
œύΆ§―Ι«Ωœ¬Θ§HFΓΔHClΓΔHBrΒΡΖ–Βψ”…ΗΏΒΫΒΆΒΡΥ≥–ρΈΣ_________Θ§‘≠“ρΈΣ_______ΓΘ
![]() ‘ΣΥΊΩ…–Έ≥…Εύ÷÷÷Ί“ΣΜ·ΚœΈοΘ§»γ
‘ΣΥΊΩ…–Έ≥…Εύ÷÷÷Ί“ΣΜ·ΚœΈοΘ§»γ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() Β»ΓΘΤδ÷–
Β»ΓΘΤδ÷–![]() ΒΡVSEPRΡΘ–ΆΈΣ_____________ΘΜ
ΒΡVSEPRΡΘ–ΆΈΣ_____________ΘΜ![]() ÷–N‘≠Ή”ΒΡ‘”Μ·–Έ ΫΈΣ__________ΘΜ
÷–N‘≠Ή”ΒΡ‘”Μ·–Έ ΫΈΣ__________ΘΜ![]() ÷–
÷–![]() Φϋ”κ
Φϋ”κ![]() ΦϋΒΡ ΐΡΩ÷°±»ΈΣ_________ΓΘ
ΦϋΒΡ ΐΡΩ÷°±»ΈΣ_________ΓΘ
![]() Ήι≥…
Ήι≥…![]() ΒΡ‘≠Ή”ΒΡΒΎ“ΜΒγάκΡή”…–ΓΒΫ¥σΒΡΥ≥–ρΈΣ___________
ΒΡ‘≠Ή”ΒΡΒΎ“ΜΒγάκΡή”…–ΓΒΫ¥σΒΡΥ≥–ρΈΣ___________![]() ”Ο‘ΣΥΊΖϊΚ≈±μ Ψ
”Ο‘ΣΥΊΖϊΚ≈±μ Ψ![]() ΘΜΤδ÷–»ΐ÷÷‘≠Ή”ΜυΧ§ ±ΥυΚ§Έ¥≥…Ε‘ΒγΉ” ΐΉνΕύΒΡ «_________
ΘΜΤδ÷–»ΐ÷÷‘≠Ή”ΜυΧ§ ±ΥυΚ§Έ¥≥…Ε‘ΒγΉ” ΐΉνΕύΒΡ «_________![]() Χν‘ΣΥΊΖϊΚ≈
Χν‘ΣΥΊΖϊΚ≈![]() ΓΘ
ΓΘ
![]() ΒΡΝΔΖΫΨßΑϊΫαΙΙ»γΆΦΥυ ΨΘ§Τδ÷–
ΒΡΝΔΖΫΨßΑϊΫαΙΙ»γΆΦΥυ ΨΘ§Τδ÷–![]() ≤…”ΟΦρΒΞΝΔΖΫΕ―ΜΐΓΘ
≤…”ΟΦρΒΞΝΔΖΫΕ―ΜΐΓΘ

![]() ”κ
”κ![]() ΫτΝΎΒΡF‘≠Ή”Ηω ΐΈΣ__________ΓΘ
ΫτΝΎΒΡF‘≠Ή”Ηω ΐΈΣ__________ΓΘ
![]() »τΨßΑϊ≤Έ ΐΈΣ
»τΨßΑϊ≤Έ ΐΈΣ![]() Θ§ΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΈΣ
Θ§ΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΈΣ![]() Θ§‘ρΨßΧεΟήΕ»ΈΣ_______
Θ§‘ρΨßΧεΟήΕ»ΈΣ_______![]() ”ΟΚ§aΓΔ
”ΟΚ§aΓΔ![]() ΒΡ¥ζ ΐ Ϋ±μ Ψ
ΒΡ¥ζ ΐ Ϋ±μ Ψ![]() ΓΘ
ΓΘ
ΓΨ¥πΑΗΓΩ![]()
![]() HFΖ÷Ή”ΦδΡή–Έ≥…«βΦϋΘ§HBr±»HClΒΡœύΕ‘Ζ÷Ή”÷ ΝΩ¥σΘ§Ζ÷Ή”ΦδΉς”ΟΝΠ¥σ ΥΡΟφΧε–Έ
HFΖ÷Ή”ΦδΡή–Έ≥…«βΦϋΘ§HBr±»HClΒΡœύΕ‘Ζ÷Ή”÷ ΝΩ¥σΘ§Ζ÷Ή”ΦδΉς”ΟΝΠ¥σ ΥΡΟφΧε–Έ ![]()
![]()
![]() Co
Co ![]()
![]()
ΓΨΫβΈωΓΩ
![]() ΚΆ
ΚΆ![]() ΨυΈΣΜυΧ§F‘≠Ή”ΒΡΙλΒά±μ¥ο ΫΘ§
ΨυΈΣΜυΧ§F‘≠Ή”ΒΡΙλΒά±μ¥ο ΫΘ§![]() ΈΣ1Ηω1sΒγΉ”‘Ψ«®ΒΫ3pΡήΦΕΘ§
ΈΣ1Ηω1sΒγΉ”‘Ψ«®ΒΫ3pΡήΦΕΘ§![]() ΈΣ1Ηω2sΒγΉ”‘Ψ«®ΒΫ3sΡήΦΕΘΜ
ΈΣ1Ηω2sΒγΉ”‘Ψ«®ΒΫ3sΡήΦΕΘΜ
![]() HFΖ÷Ή”ΦδΡή–Έ≥…«βΦϋΘ§ΤδΖ–ΒψœύΕ‘ΤδΥϊ¬±Μ·«β“ΣΗΏΘ§HBr±»HClΒΡœύΕ‘Ζ÷Ή”÷ ΝΩ¥σΘ§Ζ÷Ή”ΦδΉς”ΟΝΠ¥σΘ§Υυ“‘HBrΒΡΖ–ΒψΫœΗΏΘΜ
HFΖ÷Ή”ΦδΡή–Έ≥…«βΦϋΘ§ΤδΖ–ΒψœύΕ‘ΤδΥϊ¬±Μ·«β“ΣΗΏΘ§HBr±»HClΒΡœύΕ‘Ζ÷Ή”÷ ΝΩ¥σΘ§Ζ÷Ή”ΦδΉς”ΟΝΠ¥σΘ§Υυ“‘HBrΒΡΖ–ΒψΫœΗΏΘΜ
![]() ÷–O‘≠Ή”ΒΡΦέ≤ψΒγΉ”Ε‘ ΐΡΩΈΣ4ΘΜ
÷–O‘≠Ή”ΒΡΦέ≤ψΒγΉ”Ε‘ ΐΡΩΈΣ4ΘΜ![]() ÷–N‘≠Ή”ΒΡΦέ≤ψΒγΉ”Ε‘ ΐΈΣ4ΘΜ
÷–N‘≠Ή”ΒΡΦέ≤ψΒγΉ”Ε‘ ΐΈΣ4ΘΜ![]() ΒΡΫαΙΙ ΫΈΣ
ΒΡΫαΙΙ ΫΈΣ ΘΜ
ΘΜ
![]() ÷–F‘ΣΥΊΒΡΖ«Ϋπ τ–‘Ήν«ΩΘ§K‘ΣΥΊΒΡΫπ τ–‘Ήν«ΩΘΜΜυΧ§K‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ1Θ§ΜυΧ§Co‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ3Θ§ΜυΧ§F‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ1ΘΜ
÷–F‘ΣΥΊΒΡΖ«Ϋπ τ–‘Ήν«ΩΘ§K‘ΣΥΊΒΡΫπ τ–‘Ήν«ΩΘΜΜυΧ§K‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ1Θ§ΜυΧ§Co‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ3Θ§ΜυΧ§F‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ1ΘΜ
![]() ”…ΨßΑϊΫαΙΙΆΦ÷ΣΘ§
”…ΨßΑϊΫαΙΙΆΦ÷ΣΘ§![]() ¥Π”ΎΨßΑϊΕΞΒψΈΜ÷ΟΘ§F‘≠Ή”¥Π”ΎΨßΑϊΟφ–ΡΈΜ÷ΟΘΜ
¥Π”ΎΨßΑϊΕΞΒψΈΜ÷ΟΘ§F‘≠Ή”¥Π”ΎΨßΑϊΟφ–ΡΈΜ÷ΟΘΜ
![]() œ»»ΖΕ®ΨßΑϊΒΡΉι≥…Θ§‘Ό»ΖΕ®ΨßΑϊΒΡ÷ ΝΩΘ§‘ΌΫαΚœΟήΕ»
œ»»ΖΕ®ΨßΑϊΒΡΉι≥…Θ§‘Ό»ΖΕ®ΨßΑϊΒΡ÷ ΝΩΘ§‘ΌΫαΚœΟήΕ»![]() ΦΤΥψΓΘ
ΦΤΥψΓΘ
![]() ΚΆ
ΚΆ![]() ΨυΈΣΜυΧ§F‘≠Ή”ΒΡΙλΒά±μ¥ο ΫΘ§
ΨυΈΣΜυΧ§F‘≠Ή”ΒΡΙλΒά±μ¥ο ΫΘ§![]() ΈΣ1Ηω1sΒγΉ”‘Ψ«®ΒΫ3pΡήΦΕΘ§
ΈΣ1Ηω1sΒγΉ”‘Ψ«®ΒΫ3pΡήΦΕΘ§![]() ΈΣ1Ηω2sΒγΉ”‘Ψ«®ΒΫ3sΡήΦΕΘ§Ι
ΈΣ1Ηω2sΒγΉ”‘Ψ«®ΒΫ3sΡήΦΕΘ§Ι ![]() ±»
±»![]() ΡήΝΩΗΏΘ§
ΡήΝΩΗΏΘ§![]() ±»
±»![]() ΓΔ
ΓΔ![]() ΡήΝΩΗΏΘ§‘ρΡήΝΩ”…ΗΏΒΫΒΆΥ≥–ρΈΣ
ΡήΝΩΗΏΘ§‘ρΡήΝΩ”…ΗΏΒΫΒΆΥ≥–ρΈΣ![]() Θ§Ι ¥πΑΗΈΣDΘΜ
Θ§Ι ¥πΑΗΈΣDΘΜ
![]() HFΖ÷Ή”ΦδΡή–Έ≥…«βΦϋΘ§ΤδΖ–ΒψœύΕ‘ΤδΥϊ¬±Μ·«β“ΣΗΏΘ§HBr±»HClΒΡœύΕ‘Ζ÷Ή”÷ ΝΩ¥σΘ§Ζ÷Ή”ΦδΉς”ΟΝΠ¥σΘ§Υυ“‘HBrΒΡΖ–ΒψΫœΗΏΘ§Υυ“‘Ζ–Βψ”…ΗΏΒΫΒΆΥ≥–ρΈΣ
HFΖ÷Ή”ΦδΡή–Έ≥…«βΦϋΘ§ΤδΖ–ΒψœύΕ‘ΤδΥϊ¬±Μ·«β“ΣΗΏΘ§HBr±»HClΒΡœύΕ‘Ζ÷Ή”÷ ΝΩ¥σΘ§Ζ÷Ή”ΦδΉς”ΟΝΠ¥σΘ§Υυ“‘HBrΒΡΖ–ΒψΫœΗΏΘ§Υυ“‘Ζ–Βψ”…ΗΏΒΫΒΆΥ≥–ρΈΣ![]() ΘΜ
ΘΜ
![]() ÷–O‘≠Ή”ΒΡΦέ≤ψΒγΉ”Ε‘ ΐΡΩΈΣ4Θ§VSEPRΡΘ–ΆΈΣΥΡΟφΧε–ΈΘΜ
÷–O‘≠Ή”ΒΡΦέ≤ψΒγΉ”Ε‘ ΐΡΩΈΣ4Θ§VSEPRΡΘ–ΆΈΣΥΡΟφΧε–ΈΘΜ![]() ÷–N‘≠Ή”ΒΡΦέ≤ψΒγΉ”Ε‘ ΐΈΣ4Θ§Τδ‘”Μ·–Έ ΫΈΣ
÷–N‘≠Ή”ΒΡΦέ≤ψΒγΉ”Ε‘ ΐΈΣ4Θ§Τδ‘”Μ·–Έ ΫΈΣ![]() ΘΜ
ΘΜ![]() ΒΡΫαΙΙ ΫΈΣ
ΒΡΫαΙΙ ΫΈΣ Θ§Τδ÷–
Θ§Τδ÷–![]() Φϋ”κ
Φϋ”κ![]() ΦϋΒΡ ΐΡΩ÷°±»ΈΣ5ΘΚ1ΘΜ
ΦϋΒΡ ΐΡΩ÷°±»ΈΣ5ΘΚ1ΘΜ
![]() ÷–F‘ΣΥΊΒΡΖ«Ϋπ τ–‘Ήν«ΩΘ§K‘ΣΥΊΒΡΫπ τ–‘Ήν«ΩΘ§Ι ΒΎ“ΜΒγάκΡή”…–ΓΒΫ¥σΒΡΥ≥–ρΈΣ
÷–F‘ΣΥΊΒΡΖ«Ϋπ τ–‘Ήν«ΩΘ§K‘ΣΥΊΒΡΫπ τ–‘Ήν«ΩΘ§Ι ΒΎ“ΜΒγάκΡή”…–ΓΒΫ¥σΒΡΥ≥–ρΈΣ![]() ΘΜΜυΧ§K‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ1Θ§ΜυΧ§Co‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ3Θ§ΜυΧ§F‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ1Θ§Ι Έ¥≥…Ε‘ΒγΉ” ΐΉνΕύΒΡ «Co‘≠Ή”ΘΜ
ΘΜΜυΧ§K‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ1Θ§ΜυΧ§Co‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ3Θ§ΜυΧ§F‘≠Ή”ΒΡΈ¥≥…Ε‘ΒγΉ” ΐΈΣ1Θ§Ι Έ¥≥…Ε‘ΒγΉ” ΐΉνΕύΒΡ «Co‘≠Ή”ΘΜ
![]() ”…ΨßΑϊΫαΙΙΆΦ÷ΣΘ§
”…ΨßΑϊΫαΙΙΆΦ÷ΣΘ§![]() ¥Π”ΎΨßΑϊΕΞΒψΈΜ÷ΟΘ§F‘≠Ή”¥Π”ΎΨßΑϊΟφ–ΡΈΜ÷ΟΘ§Ι ”κ
¥Π”ΎΨßΑϊΕΞΒψΈΜ÷ΟΘ§F‘≠Ή”¥Π”ΎΨßΑϊΟφ–ΡΈΜ÷ΟΘ§Ι ”κ![]() ΫτΝΎΒΡF‘≠Ή”Ηω ΐΈΣ12ΘΜ
ΫτΝΎΒΡF‘≠Ή”Ηω ΐΈΣ12ΘΜ
![]() ”…ΨßΑϊΫαΙΙΩ…÷ΣΟΩΗωΨßΑϊΚ§”–1Ηω
”…ΨßΑϊΫαΙΙΩ…÷ΣΟΩΗωΨßΑϊΚ§”–1Ηω![]() ΓΔ1ΗωCo‘≠Ή”ΓΔ3ΗωF‘≠Ή”Θ§‘ρΨßΑϊΒΡ÷ ΝΩΈΣ
ΓΔ1ΗωCo‘≠Ή”ΓΔ3ΗωF‘≠Ή”Θ§‘ρΨßΑϊΒΡ÷ ΝΩΈΣ![]() Θ§Ι ΨßΧεΟήΕ»ΈΣ
Θ§Ι ΨßΧεΟήΕ»ΈΣ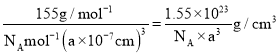 ΘΜ
ΘΜ


 ±ΨΆΝΫΧΗ®”°‘Ύ νΦΌΗΏ–ßΦΌΤΎΉήΗ¥œΑ‘ΤΡœΩΤΦΦ≥ωΑφ…γœΒΝ–¥πΑΗ
±ΨΆΝΫΧΗ®”°‘Ύ νΦΌΗΏ–ßΦΌΤΎΉήΗ¥œΑ‘ΤΡœΩΤΦΦ≥ωΑφ…γœΒΝ–¥πΑΗ νΦΌΉς“Β±±Ψ©“’ θ”κΩΤ―ßΒγΉ”≥ωΑφ…γœΒΝ–¥πΑΗ
νΦΌΉς“Β±±Ψ©“’ θ”κΩΤ―ßΒγΉ”≥ωΑφ…γœΒΝ–¥πΑΗ ΒΎ»ΐ―ßΤΎ”°‘Ύ νΦΌœΒΝ–¥πΑΗ
ΒΎ»ΐ―ßΤΎ”°‘Ύ νΦΌœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ![]() œ¬Ν–Έο÷ ÷–Θ§Φ»Κ§”–ΦΪ–‘Ι≤ΦέΦϋΘ§”÷Κ§”–Ζ«ΦΪ–‘Ι≤ΦέΦϋΒΡ «______
œ¬Ν–Έο÷ ÷–Θ§Φ»Κ§”–ΦΪ–‘Ι≤ΦέΦϋΘ§”÷Κ§”–Ζ«ΦΪ–‘Ι≤ΦέΦϋΒΡ «______
A.![]() B.
B.![]() C.
C.![]()
![]()
![]() Ρ≥άκΉ”ΨßΧεΨßΑϊΒΡΫαΙΙ»γΆΦ1Υυ ΨΘ§
Ρ≥άκΉ”ΨßΧεΨßΑϊΒΡΫαΙΙ»γΆΦ1Υυ ΨΘ§![]() ΈΜ”ΎΝΔΖΫΧε÷––ΡΘ§
ΈΜ”ΎΝΔΖΫΧε÷––ΡΘ§![]() ΈΜ”ΎΝΔΖΫΧεΕΞΒψΓΘΗΟΨßΧεΒΡΜ·―ß ΫΈΣ______
ΈΜ”ΎΝΔΖΫΧεΕΞΒψΓΘΗΟΨßΧεΒΡΜ·―ß ΫΈΣ______

A.![]()
![]() C.
C.![]()
![]()
![]() œ¬Ν–Έο÷ –‘÷ ΒΡ±δΜ·Ιφ¬…”κΦϋΡήΈόΙΊΒΡ «______
œ¬Ν–Έο÷ –‘÷ ΒΡ±δΜ·Ιφ¬…”κΦϋΡήΈόΙΊΒΡ «______
A.»»Έ»–‘ΘΚ![]()
B.»έΓΔΖ–ΒψΘΚΫπΗ’ ·![]() ΨßΧεΙη
ΨßΧεΙη
C.»έΒψΘΚ![]()
D.»έΓΔΖ–ΒψΘΚ![]()
![]() ΓΔSΓΔSe «Ά§“Μ÷ςΉε‘ΣΥΊΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
ΓΔSΓΔSe «Ά§“Μ÷ςΉε‘ΣΥΊΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
![]() ΓΔSΓΔSeΒΡΒγΗΚ–‘”…¥σΒΫ–ΓΒΡΥ≥–ρ «______ΓΘ
ΓΔSΓΔSeΒΡΒγΗΚ–‘”…¥σΒΫ–ΓΒΡΥ≥–ρ «______ΓΘ
![]() «______Ζ÷Ή”
«______Ζ÷Ή”![]() ΧνΓΑΦΪ–‘Γ±ΜρΓΑΖ«ΦΪ–‘Γ±
ΧνΓΑΦΪ–‘Γ±ΜρΓΑΖ«ΦΪ–‘Γ±![]() Θ§÷––Ρ‘≠Ή”ΒΡΙλΒά‘”Μ·άύ–ΆΈΣ______Θ§
Θ§÷––Ρ‘≠Ή”ΒΡΙλΒά‘”Μ·άύ–ΆΈΣ______Θ§![]() Ζ÷Ή”ΒΡΝΔΧεΙΙ–ΆΟϊ≥Τ «______ΓΘ
Ζ÷Ή”ΒΡΝΔΧεΙΙ–ΆΟϊ≥Τ «______ΓΘ
![]() ΒΡΖ–ΒψΗΏ”Ύ
ΒΡΖ–ΒψΗΏ”Ύ![]() ΒΡΖ–ΒψΘ§Τδ‘≠“ρ «______ΓΘ
ΒΡΖ–ΒψΘ§Τδ‘≠“ρ «______ΓΘ
![]() ”κ
”κ![]() Ζ÷Ή”ΜΞΈΣΒ»ΒγΉ”ΧεΒΡ“θάκΉ”ΈΣ______
Ζ÷Ή”ΜΞΈΣΒ»ΒγΉ”ΧεΒΡ“θάκΉ”ΈΣ______![]() ΧνΜ·―ß Ϋ
ΧνΜ·―ß Ϋ![]() ΓΘ
ΓΘ
![]() “―÷ΣSe‘≠Ή”±»O‘≠Ή”Εύ2ΗωΒγΉ”≤ψΘ§ΜυΧ§Se‘≠Ή”ΚΥΆβΒγΉ”≈≈≤Φ ΫΈΣ______Θ§”–______ΗωΈ¥≥…Ε‘ΒγΉ”ΓΘ
“―÷ΣSe‘≠Ή”±»O‘≠Ή”Εύ2ΗωΒγΉ”≤ψΘ§ΜυΧ§Se‘≠Ή”ΚΥΆβΒγΉ”≈≈≤Φ ΫΈΣ______Θ§”–______ΗωΈ¥≥…Ε‘ΒγΉ”ΓΘ
![]() άκΜ·ΚœΈο
άκΜ·ΚœΈο![]() ΒΡΨßΑϊ»γΆΦΥυ ΨΘ§
ΒΡΨßΑϊ»γΆΦΥυ ΨΘ§![]() ΒΡ≈δΈΜ ΐ «______ΘΜ»τΑΔΖϋΦ”Β¬¬ό≥Θ ΐ÷ΒΈΣ
ΒΡ≈δΈΜ ΐ «______ΘΜ»τΑΔΖϋΦ”Β¬¬ό≥Θ ΐ÷ΒΈΣ![]() Θ§ΨßΑϊ≤Έ ΐΈΣanmΘ§Ν– ΫΦΤΥψΨßΧεΒΡΟήΕ»
Θ§ΨßΑϊ≤Έ ΐΈΣanmΘ§Ν– ΫΦΤΥψΨßΧεΒΡΟήΕ»![]() ______
______![]() ÷ΜΝ– ΫΘ§≤Μ”ΟΦΤΥψΉνΚσΫαΙϊ
÷ΜΝ– ΫΘ§≤Μ”ΟΦΤΥψΉνΚσΫαΙϊ![]() ΓΘ
ΓΘ

≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΦΉ¥Φ”÷≥ΤΓΑΡΨ¥ΦΓ±Θ§ «Έό…Ϊ”–ΨΤΨΪΤχΈΕ“ΉΜ”ΖΔΒΡ”–ΕΨ“ΚΧεΓΘΦΉ¥Φ «÷Ί“ΣΒΡΜ·―ßΙΛ“ΒΜυ¥Γ‘≠ΝœΚΆ“ΚΧε»ΦΝœΘ§Ω…”Ο”Ύ÷Τ‘λΦΉ»©ΚΆ≈©“©Θ§≤Δ≥Θ”ΟΉς”–ΜζΈοΒΡίΆ»ΓΦΝΚΆΨΤΨΪΒΡ±δ–‘ΦΝΒ»ΓΘ
Θ®1Θ©ΙΛ“Β…œΩ…άϊ”ΟCO2ΚΆH2…ζ≤ζΦΉ¥ΦΘ§ΖΫ≥Χ Ϋ»γœ¬ΘΚ
CO2Θ®gΘ©ΘΪ3H2Θ®gΘ©![]() CH3OHΘ®lΘ©ΘΪH2O Θ®gΘ© ΓςHΘΫQ1kJΓΛmolΘ≠1
CH3OHΘ®lΘ©ΘΪH2O Θ®gΘ© ΓςHΘΫQ1kJΓΛmolΘ≠1
”÷≤ιΉ ΝœΒΟ÷ΣΘΚΔΌCH3OHΘ®lΘ©ΘΪ1/2 O2Θ®gΘ©![]() CO2Θ®gΘ©ΘΪ2H2Θ®gΘ© ΓςHΘΫQ2kJΓΛmolΘ≠1
CO2Θ®gΘ©ΘΪ2H2Θ®gΘ© ΓςHΘΫQ2kJΓΛmolΘ≠1
ΔΎH2OΘ®gΘ©=H2OΘ®lΘ© ΓςH= Q3kJΓΛmolΘ≠1Θ§‘ρ±μ ΨΦΉ¥ΦΒΡ»Φ…’»»ΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣ______ΓΘ
Ρ≥Ά§―ß…ηΦΤΝΥ“ΜΗωΦΉ¥Φ»ΦΝœΒγ≥ΊΘ§≤Δ”ΟΗΟΒγ≥ΊΒγΫβ200mL“ΜΕ®≈®Ε»ΒΡNaCl”κCuSO4ΜλΚœ»ή“ΚΘ§ΤδΉΑ÷Ο»γΆΦΘΚ
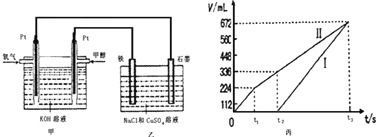
Θ®2Θ©ΈΣ≥ΐ»Ξ±ΞΚΆ ≥―ΈΥ°÷–ΒΡοßΗυάκΉ”Θ§Ω…‘ΎΦν–‘ΧθΦΰœ¬Ά®»κ¬»ΤχΘ§Ζ¥”Π…ζ≥…ΒΣΤχΓΘΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___________________________________ΓΘ
Θ®3Θ©ΙΐΝΩ¬»Τχ”ΟNa2S2O3≥ΐ»ΞΘ§Ζ¥”Π÷–S2O32-±Μ―θΜ·ΈΣSO42-ΓΘ»τΙΐΝΩΒΡ¬»ΤχΈΣ1ΓΝ10-3molΘ§‘ράμ¬έ…œ…ζ≥…ΒΡSO42-ΈΣ_____________molΓΘ
Θ®4Θ©–¥≥ωΦΉ÷–Ά®»κΦΉ¥Φ’β“ΜΦΪΒΡΒγΦΪΖ¥”Π Ϋ______________________ΓΘ
Θ®5Θ©άμ¬έ…œ““÷–ΝΫΦΪΥυΒΟΤχΧεΒΡΧεΜΐΥφ ±Φδ±δΜ·ΒΡΙΊœΒ»γ±ϊΆΦΥυ ΨΘ®“―ΜΜΥψ≥…±ξΉΦΉ¥Ωωœ¬ΒΡΧεΜΐΘ©Θ§–¥≥ω‘Ύt1ΚσΘ§ ·ΡΪΒγΦΪ…œΒΡΒγΦΪΖ¥”Π Ϋ____________Θ§‘≠ΜλΚœ»ή“Κ÷– NaClΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ___________mol/LΓΘΘ®…η»ή“ΚΧεΜΐ≤Μ±δΘ©
Θ®6Θ©Β±œρ…œ ωΦΉΉΑ÷Ο÷–Ά®»κ±ξΩωœ¬ΒΡ―θΤχ336mL ±Θ§άμ¬έ…œ‘ΎΧζΒγΦΪ…œΩ…Έω≥ωΆ≠ΒΡ÷ ΝΩΈΣ_____________gΓΘ
Θ®7Θ©»τ Ι…œ ωΒγΫβΉΑ÷ΟΒΡΒγΝς«ΩΕ»¥οΒΫ5Θ°0AΘ§άμ¬έ…œΟΩΖ÷÷””ΠœρΗΚΦΪΆ®»κΤχΧεΒΡ÷ ΝΩΈΣ_____________ΩΥΓΘΘ®“―÷Σ1ΗωΒγΉ”Υυ¥χΒγΝΩΈΣ1Θ°6ΓΝ10-19CΘ§ΦΤΥψΫαΙϊ±ΘΝτΝΫΈΜ”––ß ΐΉ÷Θ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΡ―»ή–‘Έο÷ K2SO4ΓΛMgSO4ΓΛ2CaSO4‘ΎΥ°÷–¥φ‘Ύ»γœ¬ΤΫΚβΘΚK2SO4ΓΛMgSO4ΓΛ2CaSO4 (s)![]() 2Ca2ΘΪΘΪ2KΘΪΘΪMg2ΘΪΘΪ4SO42Θ≠ΓΘ≤ΜΆ§Έ¬Ε»œ¬Θ§KΘΪΒΡΫΰ≥ω≈®Ε»”κ»ήΫΰ ±ΦδΒΡΙΊœΒ»γΆΦΥυ ΨΘ§‘ρœ¬Ν–ΥΒΖ®¥μΈσΒΡ «
2Ca2ΘΪΘΪ2KΘΪΘΪMg2ΘΪΘΪ4SO42Θ≠ΓΘ≤ΜΆ§Έ¬Ε»œ¬Θ§KΘΪΒΡΫΰ≥ω≈®Ε»”κ»ήΫΰ ±ΦδΒΡΙΊœΒ»γΆΦΥυ ΨΘ§‘ρœ¬Ν–ΥΒΖ®¥μΈσΒΡ «

A.ΗΟΤΫΚβΒΡKspΘΫc2(Ca2ΘΪ)ΓΛc2(KΘΪ)ΓΛc(Mg2ΘΪ)ΓΛc4(SO42Θ≠)B.œρΗΟΧεœΒ÷–Φ”»κ±ΞΚΆK2SO4»ή“ΚΘ§»ήΫβΤΫΚβœρΉσ“ΤΕ· C.…ΐΗΏΈ¬Ε»Θ§»ήΫΰΥΌ¬ ‘ω¥σΘ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ· D.œρΗΟΧεœΒ÷–Φ”»κ±ΞΚΆNaOH»ή“ΚΘ§»ήΫβΤΫΚβ≤ΜΖΔ…ζ“ΤΕ·
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§œ¬Ν–ΗςΉιάκΉ”‘Ύ÷ΗΕ®»ή“ΚΡή¥σΝΩΙ≤¥φΒΡ «
A.pHΘΫ1ΒΡ»ή“Κ÷–ΘΚFe2ΘΪΓΔNO3-ΓΔSO42-ΓΔNaΘΪ
B.”…Υ°ΒγάκΒΡc(HΘΪ)ΘΫ1ΓΝ10Θ≠14molΓΛLΘ≠1ΒΡ»ή“Κ÷–ΘΚCa2ΘΪΓΔKΘΪΓΔClΘ≠ΓΔHCO3-
C.![]() ΘΫ1012ΒΡ»ή“Κ÷–ΘΚNH4+ΓΔAl3ΘΪΓΔNO3-ΓΔClΘ≠
ΘΫ1012ΒΡ»ή“Κ÷–ΘΚNH4+ΓΔAl3ΘΪΓΔNO3-ΓΔClΘ≠
D.c(Fe3ΘΪ)ΘΫ0.1 molΓΛLΘ≠1ΒΡ»ή“Κ÷–ΘΚKΘΪΓΔClOΘ≠ΓΔSO42-ΓΔSCNΘ≠
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§œ¬Ν–ΗςΉιάκΉ”‘Ύ÷ΗΕ®ΜΖΨ≥÷–Ρή¥σΝΩΙ≤¥φΒΡ «(ΓΓΓΓ)
A.‘Ύ ΘΫ1013ΒΡ»ή“Κ÷–ΘΚNH4+ΓΔCa2ΘΪΓΔCl-ΓΔKΘΪ
ΘΫ1013ΒΡ»ή“Κ÷–ΘΚNH4+ΓΔCa2ΘΪΓΔCl-ΓΔKΘΪ
B.”…Υ°Βγάκ≥ωΒΡc(H+)=1ΓΝ10Θ≠13mol/LΒΡ»ή“Κ÷–ΘΚNaΘΪΓΔHCO3-ΓΔCl-ΓΔKΘΪ
C.Έό…Ϊ»ή“Κ÷–Ω…Ρή¥σΝΩ¥φ‘ΎAl3+ΓΔNH4+ΓΔCl-ΓΔS2-
D.÷––‘»ή“Κ÷–Ω…Ρή¥σΝΩ¥φ‘ΎFe3+ΓΔK+ΓΔCl-ΓΔSO42-
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ “Έ¬œ¬Θ§œ¬Ν–ΗςΉιάκΉ”Ρή¥σΝΩΙ≤¥φΒΡ «Θ®ΓΓΓΓΘ©
A. œΓΝρΥα÷–ΘΚK+ΓΔMg2+ΓΔA1O2-ΓΔS2O32-
B. KW/c(H+)=10-13 molΓΛL-1 ΒΡ»ή“Κ÷–ΘΚFe3+ΓΔNH4+ΓΔMg2+ΓΔSO42-
C. ΙΦΉΜυ≥»±δΚλΒΡ»ή“Κ÷–ΘΚFe2+ΓΔMnO4©¹ΓΔNa+ΓΔSO42©¹
D. Ά®»κ¥σΝΩ CO2 ΒΡ»ή“Κ÷–ΘΚNa+ΓΔClO-ΓΔCH3COO-ΓΔHCO3-
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ¬ιΜΤΥΊM «ΡβΫΜΗ–…ώΨ≠“©ΓΘΚœ≥…MΒΡ“Μ÷÷¬ΖœΏ»γΆΦΥυ ΨΘΚ

“―÷ΣΘΚΔώΘ°ΖΦœψΧΰAΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΈΣ92
ΔρΘ°RΓΣCH2OH![]() RCHO
RCHO
IIIΘ°R1-CHO+
IVΘ°
VΘ°
«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©DΒΡΟϊ≥Τ «_______ΘΜG÷–Κ§―θΙΌΡήΆ≈ΒΡΟϊ≥Τ «_______ΓΘ
Θ®2Θ©Ζ¥”ΠΔΎΒΡΖ¥”Πάύ–ΆΈΣ_______ΘΜAΒΡΫαΙΙΦρ ΫΈΣ_______ΓΘ
Θ®3Θ©–¥≥ωΖ¥”ΠΔΏΒΡΜ·―ßΖΫ≥Χ ΫΘΚ______________________________ΓΘ
Θ®4Θ©XΖ÷Ή”÷–ΉνΕύ”–_______ΗωΧΦ‘≠Ή”Ι≤ΤΫΟφΓΘ
Θ®5Θ©‘ΎHΒΡΆ§Ζ÷“λΙΙΧε÷–Θ§Ά§ ±ΡήΖΔ…ζΥ°ΫβΖ¥”ΠΚΆ“χΨΒΖ¥”ΠΒΡΖΦœψΉεΜ·ΚœΈο÷–Θ§ΚΥ¥≈Ι≤’ώ«βΤΉ…œ”–4ΉιΖεΘ§«“ΖεΟφΜΐ÷°±»ΈΣ1ΓΟ1ΓΟ2ΓΟ6ΒΡ”–ΜζΈοΒΡΫαΙΙΦρ ΫΈΣ_________________ΓΘ
Θ®6Θ©“―÷ΣΘΚ![]() Ζ¬’’…œ ωΝς≥ΧΘ§…ηΦΤ“‘±ΫΓΔ““»©ΈΣ÷ς“Σ‘≠ΝœΚœ≥…Ρ≥“©Έο÷–ΦδΧε
Ζ¬’’…œ ωΝς≥ΧΘ§…ηΦΤ“‘±ΫΓΔ““»©ΈΣ÷ς“Σ‘≠ΝœΚœ≥…Ρ≥“©Έο÷–ΦδΧε![]() ΒΡ¬ΖœΏ________________ΓΘ
ΒΡ¬ΖœΏ________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣH2O2ΓΔKMnO4ΓΔNaClOΓΔK2Cr2O7ΨυΨΏ”–«Ω―θΜ·–‘ΓΘΫΪ»ή“Κ÷–ΒΡCu2ΘΪΓΔFe2ΘΪΓΔFe3ΘΪ≥ΝΒμΈΣ«β―θΜ·ΈοΘ§–η»ή“ΚΒΡpHΖ÷±πΈΣ6.4ΓΔ9.6ΓΔ3.7ΓΘœ÷”–Κ§FeCl2‘”÷ ΒΡ¬»Μ·Ά≠ΨßΧε(CuCl2ΓΛ2H2O)Θ§ΈΣ÷Τ»Γ¥ΩΨΜΒΡCuCl2ΓΛ2H2OΘ§ Ήœ»ΫΪΤδ÷Τ≥…Υ°»ή“ΚΘ§»ΜΚσΑ¥ΆΦ Ψ≤Ϋ÷ηΫχ––Χα¥ΩΘΚ

«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©±Ψ Β―ιΉν ΚœΒΡ―θΜ·ΦΝX «___(Χν–ρΚ≈)ΓΘ
AΘ°K2Cr2O7 BΘ°NaClO CΘ°H2O2 DΘ°KMnO4
Θ®2Θ©Έο÷ Y «____ΓΘ
Θ®3Θ©±Ψ Β―ι”ΟΦ”Φν≥ΝΒμΖ®Ρή≤ΜΡή¥οΒΫΡΩΒΡΘΩ___Θ§‘≠“ρ «___ΓΘ
Θ®4Θ©≥ΐ»ΞFe3ΘΪΒΡ”–ΙΊάκΉ”ΖΫ≥Χ Ϋ «____ΓΘ
Θ®5Θ©Φ”―θΜ·ΦΝΒΡΡΩΒΡ «____ΓΘ
Θ®6Θ©ΉνΚσΡή≤ΜΡή÷±Ϋ”’τΖΔΫαΨßΒΟΒΫCuCl2ΓΛ2H2OΨßΧε___Θ§”Π»γΚΈ≤ΌΉς___ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com