
A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如下图所示。A为地壳中含量仅次于氧的非金属单质,其晶体结构与金刚石相似。
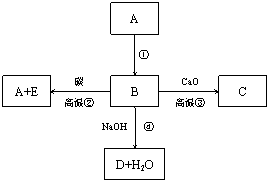 |
请依据信息和转化关系,回答下列问题:
(1)形成单质A的原子结构示意图为 ,它的最高化合价为 。
(2)B的化学式为 ,B和碳反应生成A和E的化学方程式为 。
(3)C的化学式 为 ,D的化学式为 。
为 ,D的化学式为 。
(4)图中 反应(填写序号)能够说明盛装碱液的试剂瓶不能用磨口玻璃塞而应用橡胶塞,反应的离子方程式为 。
(5)A转化 为B的条件是 。
为B的条件是 。
科目:高中化学 来源: 题型:
化学反应原理在科研和工农业生产中有广泛应用。
 (1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)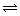 2NH3(g)
2NH3(g)  。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间
。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间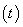 的变化如下图所示:
的变化如下图所示:
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
a.增大压强 b.减小压强 C.升高温度d.降低温度 e.使用催化剂
(2)已知NO2与N2O4可以相互转化: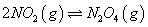 。
。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol·L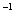 ,则该反应的平衡常数K=_______________;
,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
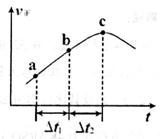 ③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.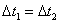 时,NO2的转化率:a~b段小于 b~c段
时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol·L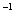 的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3
的氨水与b mol·L一1盐酸等体积混合,反应后溶液恰好显中性,则a___________b(填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数
H2O的电离平衡常数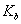 =________________。
=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应能够证明硅酸是弱酸的是( )。
A.Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓
B.Na2SiO3+2HCl===2NaCl+H2SiO3↓
C.H2SiO3+2NaOH==Na2SiO3+2H2O
D.H2SiO3 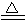 SiO2+H2O
SiO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
PbO2微热时会分解成PbO和O2,PbO是一种不溶于水但易溶于酸的黄色物质。把适量黑褐色的PbO2粉末投入热水中,一边搅拌,一边通入SO2气体,结果得到白色不溶物。下列判断中错误的是( )。
A.PbO2具有氧化性 B.白色不溶物为PbSO3
C.白色不溶物为PbSO4 D.白色不溶物既是氧化产物,又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Si+2NaOH+H2O===Na2SiO3+2H2↑。将一定量的硅粉与金属钠的混合物投入到足量的水中,生成标准状况下的无色气体6.72L,同时得到无色透明溶液,且溶液中只含有一种溶质。试求原混合物中硅和金属钠各自的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
将NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )
A.NH3 B.O2 C.H2O D.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
某气体分子,其摩尔质量为M g/mol,该气体的体积为V L(标况)溶于1L水中,形成溶液的密度为d g /cm3 设阿伏加德罗常数的值为NA 则:
①该气体的物质的量为________ mol;(用含d 、 V 、M的代数式表示,下同) ②该溶液中溶质的质量分数________; ③该气体在标准状况下的密度为________g/L; ④该溶液中溶质的物质的量浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com