
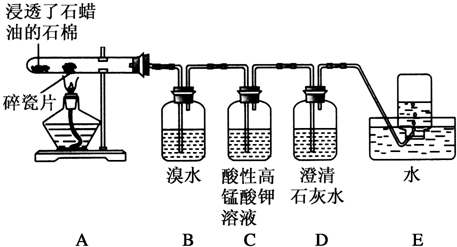
分析 探究工业制乙烯的原理和乙烯的主要化学性质,由实验装置可知,A中烷烃在催化剂和加热条件下发生反应生成不饱和烃,B中乙烯与溴水发生加成反应,C中乙烯与高锰酸钾发生氧化反应,D中吸收C中生成的二氧化碳,E中利用排水法收集乙烯.
(1)结合原子守恒分析分子式,乙为乙烯;
(2)B中乙烯与溴水反应;
(3)C中乙烯与高锰酸钾反应;
(4)D中石灰水变浑浊可说明C中反应,探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,因加成产物只有卤代烃,而取代产物中有HBr;
(5)乙烯含双键、与溴水、高锰酸钾反应,而甲烷不能,结合除杂时不能引入新杂质来解答.
解答 解:探究工业制乙烯的原理和乙烯的主要化学性质,由实验装置可知,A中烷烃在催化剂和加热条件下发生反应生成不饱和烃,B中乙烯与溴水发生加成反应,C中乙烯与高锰酸钾发生氧化反应,D中吸收C中生成的二氧化碳,E中利用排水法收集乙烯.
(1)由C16H34$→_{△}^{催化剂}$C8H18+甲,甲$→_{△}^{催化剂}$4乙及原子守恒可知甲为C8H16,乙为CH2═CH2,故答案为:C8H16;CH2═CH2;
(2)B装置中的实验现象可能是橙色(或橙黄色)褪去,反应的化学方程式为CH2═CH2+Br2→BrCH2-CH2Br,其反应类型是,
故答案为:橙色(或橙黄色)褪去;CH2═CH2+Br2→BrCH2-CH2Br;加成反应;
(3)C装置中可观察到的现象是紫色(或紫红色)褪去,反应类型是氧化反应,故答案为:紫色(或紫红色)褪去;氧化反应;
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳.根据本实验中装置D中的实验现象(石灰水变浑浊)可判断该资料是否真实.为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,简述其理由为若乙烯与溴发生取代反应生成HBr,其溶液酸性会显著增强,
故答案为:D;若乙烯与溴发生取代反应生成HBr,其溶液酸性会显著增强;
(5)A.气体通入水中,二者均与水不反应,不能除杂,也不能鉴别;
B.气体通过盛溴水的洗气瓶,乙烯与溴水反应,而甲烷不能,可鉴别,也可除去甲烷中的乙烯;
C.气体通过盛酸性高锰酸钾溶液的洗气瓶,乙烯与高锰酸钾反应,而甲烷不能,可鉴别,但反应生成二氧化碳,引入新杂质,不能除杂;
D.气体通过氢氧化钠溶液,二者均不反应,不能除杂,也不能鉴别.
故答案为:BC;B;
点评 本题考查乙烯的制备及性质实验,为高频考点,把握制备原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意有机物性质及鉴别、除杂的综合应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 温度、容积不变,充入NH3 | B. | 温度、容积不变时,充入SO2气体 | ||
| C. | 充入N2,保持压强不变 | D. | 移走一部分NH4HS固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 5 | C. | 4 | D. | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质焰色反应呈黄色,结论:该物质一定是钠盐 | |
| B. | 无色盐溶液中加入NaOH溶液,加热后产生的气体能使湿润的红色石蕊试纸变蓝,结论:原溶液中一定含有NH4+ | |
| C. | 无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,结论:原溶液一定含有SO42- | |
| D. | 无色溶液中加入稀盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是由Na+与O22-(填写离子符号)构成的.
,它是由Na+与O22-(填写离子符号)构成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易燃试剂与强氧化试剂分开放置并远离火源 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50ml量筒中配制0.1000mol•L-1硫酸钠 | |
| D. | 实验室酒精灯着火时,用湿抹布覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铜的精炼中,粗铜为阳极 | |
| B. | 铜在空气中也容易生锈,可用稀硝酸洗涤 | |
| C. | 铜离子氧化性较强,能氧化I-,所以Cu2+与S2-反应将生成硫单质 | |
| D. | 铜金属性比铁弱,因此Cu2+与铁反应生成Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com