
| A. | 54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA | |
| B. | 同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 | |
| C. | 1 mol•L-1的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 11.2 L氧气中所含有的原子数为NA |
分析 A、求出铝的物质的量,然后根据反应后铝元素为+3价来分析;
B、NA个NO2与NA个N2和O2的混合物的物质的量均为1mol;
C、溶液体积不明确;
D、氧气所处的状态不明确.
解答 解:A、54g铝的物质的量为2mol,而反应后铝元素为+3价,故2mol铝失去6mol电子即6NA个,故A正确;
B、NA个NO2与NA个N2和O2的混合物的物质的量均为1mol,故在同温同压下,气体的体积相同,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、氧气所处的状态不明确,故氧气的物质的量无法计算,则含有的氧原子的个数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5molAl与足量盐酸反应转移电子数为1NA | |
| B. | 标准状况下,22.4L氨气与22.4L氮气所含原子数均为2NA | |
| C. | 7.8gNa2O2所含的离子数为0.3NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液的pH<7,说明该溶液一定呈酸性 | |
| B. | 常温时pH=3的盐酸溶液与pH=5盐酸溶液等体积混合后溶液的pH=4 | |
| C. | 0.2 mol•L-1的盐酸,与等体积水混合后pH=1 | |
| D. | 常温时pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氧化剂是CO、还原剂是NO2 | |
| B. | 该反应是氧化还原反应 | |
| C. | 该反应生成28 g N2时,转移8 mol e- | |
| D. | 该反应能减少汽车尾气对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍原子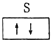 | B. | 碳原子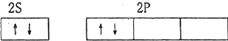 | ||
| C. | 氯原子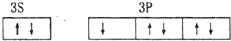 | D. | 铝原子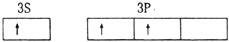 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com