
| A. | c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| B. | c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-) | |
| C. | c(OH-)-c(HC2O4-)=c(H+)+2c(H2C2O4) | |
| D. | c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
分析 盐Na2C2O4的溶液中C2O42-水解呈碱性,
A、结合电荷守恒分析,阴阳离子所带电荷数相同,电性相反;
B、依据物料守恒判断,n(Na)=2n(C2O42-);
C、Na2C2O4溶液中存在c(Na+)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4),c(Na+)+c(H+)=c(OH-)+c(HC2O4--)+2c(C2O42-),二者联立分析判断;
D、草酸根离子分步水解溶液显碱性.
解答 解:A、由电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故A错误;
B、由物料守恒可知,Na2C2O4溶液中存在c(Na+)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4),故B正确;
C、Na2C2O4溶液中存在c(Na+)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4),电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),二者联式可得Na2C2O4溶液中存在c(HC2O4-)+2c(H2C2O4)+c(H+)=c(OH-),c(OH-)-c(HC2O4-)=c(H+)+2c(H2C2O4),故C正确;
D、草酸根离子分步水解溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+),故D正确;
故选A.
点评 本题考查离子浓度的大小比较,题目难度中等,注意把握电解质的电离和盐类水解原理,结合守恒的方法解答该题.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①④⑥ | C. | ②③⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl溶于水和NaCl溶于水 | B. | 干冰升华和碘升华 | ||
| C. | NH4Cl受热分解和HI受热分解 | D. | 石英熔化和冰熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 溶液中先产生的是AgI沉淀 | |
| C. | AgCl的KSP的数值为1.69×10-10 | |
| D. | 若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
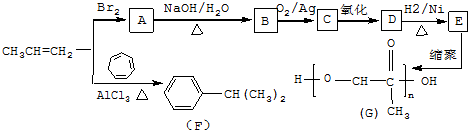
 ,C发生银镜反应的化学方程式
,C发生银镜反应的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 0.5 | 2.0 | 36.0 | |
| ③ | 碳粉质量的影响 | 0.2 | 90.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
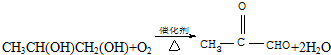
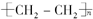 ?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.
?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n+11 | B. | n-5 | C. | n+3 | D. | n+5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com