
【题目】一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:
A(g)+2B(g) ![]() 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=______________。在保证A浓度不变的情况下,扩大容器的体积,平衡________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。

①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时____________________________________________________________________;
t8时____________________________________________________________________。
②t2时平衡向________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。______
【答案】 BC ![]() C 升温或增大C的浓度 使用催化剂 逆反应
C 升温或增大C的浓度 使用催化剂 逆反应 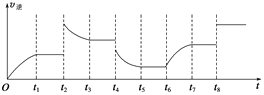
【解析】(1)平衡状态的判断依据是正逆反应速率相等,各组分的浓度保持不变。 A.反应物A与B加入的反应物的物质的量之比等于其化学计量数之比,所以任何时刻A与B的转化率之比等于化学计量数之比为1:2,不能说明达到平衡状态,A错误; B.假设A转化率为x,则平衡后有A、B、C物质的量分别为(n-nx)mol、(2n-2nx)mol、2nxmol,平衡后气体总物质的量为(3n-nx)mol,恒容容器中,气体物质的量之比等于其压强之比,B正确;C.当2v正(A)=v逆(B)时,说明正逆反应速率相等,反应达到平衡状态,C正确;D.恒容容器中,充入惰性气体(如Ar),由于各种物质的浓度不变,所以化学平衡不移动,D错误;答案选BC;(2)在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g)![]() 2C(g) △H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x,则化学平衡常数
2C(g) △H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x,则化学平衡常数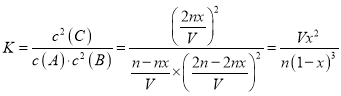 ;增大容器体积时,c(B)和c(C)等比例减小,由于A的浓度不变,此时
;增大容器体积时,c(B)和c(C)等比例减小,由于A的浓度不变,此时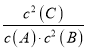 的值仍然等于K,所以平衡不移动,答案选C;(3)①由于纵坐标只表示v逆,t2 时平衡逆向移动,由于该反应的正反应是气体体积减小的放热反应,所以根据平衡移动原理可知,采用的条件可以是升温或增大C的浓度;t8 时正反应速率和逆反应速率都增大,由于二者仍然相等,所以化学平衡不移动,采用的条件是使用了催化剂;②t2 时逆反应速率突然增大,且平衡时反应速率大于t2 时反应速率,平衡向逆反应方向移动;③若t4时降压,物质的浓度降低,反应速率减小,由于反应物的系数大于生成物的稀释,所以正反应速率减小的倍数大于逆反应速率减小的倍数,化学平衡逆向移动,至t5时达到平衡,t6时增大反应物的浓度,化学平衡正向移动,逆反应的速率增大,至t7时达到平衡状态,所以t4~t6时逆反应速率随时间变化的曲线表示为
的值仍然等于K,所以平衡不移动,答案选C;(3)①由于纵坐标只表示v逆,t2 时平衡逆向移动,由于该反应的正反应是气体体积减小的放热反应,所以根据平衡移动原理可知,采用的条件可以是升温或增大C的浓度;t8 时正反应速率和逆反应速率都增大,由于二者仍然相等,所以化学平衡不移动,采用的条件是使用了催化剂;②t2 时逆反应速率突然增大,且平衡时反应速率大于t2 时反应速率,平衡向逆反应方向移动;③若t4时降压,物质的浓度降低,反应速率减小,由于反应物的系数大于生成物的稀释,所以正反应速率减小的倍数大于逆反应速率减小的倍数,化学平衡逆向移动,至t5时达到平衡,t6时增大反应物的浓度,化学平衡正向移动,逆反应的速率增大,至t7时达到平衡状态,所以t4~t6时逆反应速率随时间变化的曲线表示为 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
HCl:____________________;Ca(OH)2:_________________;
NH3·H2O:_________________;NH4NO3:_________________;
H2CO3:______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今世界,能源的发展日益成为全世界、全人类共同关注的问题,乙烷、二甲醚的燃烧热较大,可用作燃料。如图是乙烷、二甲醚燃烧过程中的能量变化图。

请回答下列问题:
(1)乙烷的燃烧热ΔH= kJ·mol-1。
(2)等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物时放出的热量 (填“多”或“少”)。
(3)根据题图写出二甲醚完全燃烧时的热化学方程式 。
(4)二氧化碳是温室气体,从环保角度分析,放出相同的热量时选择 (填“乙烷”或“二甲醚”)作为燃料产生的CO2较少。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 64.0 | 50.7 | 42.9 |
请回答下列问题:
①该反应的平衡常数表达式K=__________,ΔH____0(填“>”、“<”或“=”)。
②在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率为________。
③欲提高②中CO的平衡转化率,可采取的措施是_____________________。
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是________。

(3)写出氢氧化铝在水中发生碱式电离的电离方程式:
_________________________________________________________。
欲使上述体系中Al3+浓度增加,可加入的物质是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明胶是水溶性蛋白质混合物、溶于水会形成胶体。工业明胶制成的胶囊中往往含有超标的重金属Cr,因而对人体造成伤害。
(1)用一束光照射明胶水溶液,可观察到______现象。
(2)Na2CrO4是工业上常用的氧化剂,工业上可用FeCr2O4(Cr元素的化台价为+3)制Na2CrO4,其反应为FeCr2O4+8Na2CO3+Na2CrO4+7O2 ![]() Na2CrO4+Fe2O3+8CO2↑。
Na2CrO4+Fe2O3+8CO2↑。
①FeCr2O4铁元素的化合价为_______,用氧化物的形式表示FeCr2O4的化学式:________
②该反应的氧化产物是_______;每生成1molNa2CrO4时,转移电子_____ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列反应类型的判断,不正确的是( )
A. H2CO3![]() CO2↑+H2O(分解反应)
CO2↑+H2O(分解反应)
B. 3CO+Fe2O3![]() 2Fe+3CO2(置换反应)
2Fe+3CO2(置换反应)
C. 2KClO3![]() 2KCl+3O2↑(氧化还原反应)
2KCl+3O2↑(氧化还原反应)
D. 2FeCl2+Cl2====2FeCl3(化合反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量可向盐酸中加入适量的
A. NaOH(固体) B. Fe( NO3)3溶液
C. NH4Cl(固体) D. CH3COONa(固体)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com