
| A. | SiO2为分子晶体,Si为原子晶体 | |
| B. | Si是光导纤维的主要成分 | |
| C. | 在该反应条件下,C的氧化性强于Si的氧化性 | |
| D. | 每生成1 mol Si理论上转移的电子数目约为4×6.02×1023 |
分析 A、二氧化硅和硅都是原子晶体;
B、光导纤维的主要成分是二氧化硅;
C、反应中碳是还原剂;
D、每生成1 mol Si理论上转移的电子的物质的量为2×2mol.
解答 解:A、二氧化硅和硅都是原子晶体,故A错误;
B、光导纤维的主要成分是二氧化硅,而硅是半导体材料,故B错误;
C、反应中碳是还原剂,而不是氧化性,故C错误;
D、每生成1 mol Si理论上转移的电子的物质的量为2×2mol,所以每生成1 mol Si理论上转移的电子数目约为4×6.02×1023,故D正确;
故选D.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握元素化合价的判断,从化合价的角度认识相关概念和物质的性质,难度不大.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀盐酸:Ba(OH)2+2H+═Ba2++2H2O | |
| B. | 碘化钠溶液和溴水反应:I-+Br2═I2+Br- | |
| C. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 实验室用浓盐酸和MnO2制Cl2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
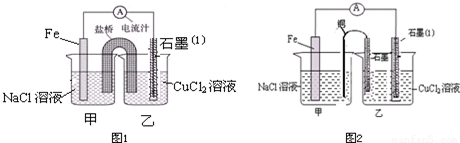
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
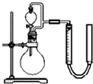 锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:| 序号 | 烧瓶中的物质 | 气体体积 | MnO2的作用 |
| 实验1 | 足量MnO2 | 56mL | |
| 实验2 | 足量MnO2和稀硫酸 | 112mL |
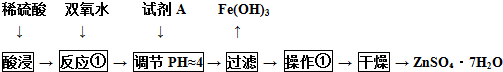
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用强碱溶液吸收硝酸工业的尾气:NO+NO2+2OH-═2NO2-+H2O | |
| B. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NH3↑+2H2O | |
| C. | 明矾净水:Al3++3H2O═Al(OH)3↓+3H+ | |
| D. | 苯酚加入NaHCO3溶液中:C6H5OH+HCO3-→C6H5O-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 向容器中再加入N2可以加快反应速率 | |
| C. | 达到化学反应限度时,生成2 mol NH3 | |
| D. | 达到化学平衡时 N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 3mol/LKCl溶液 | B. | 75mL 2mol/LMgCl2溶液 | ||
| C. | 100mL1mol/LNaCl溶液 | D. | 50mL 3mol/LAlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 周期表中原子半径最小的元素 |
| T | 最外层电子数是次外层电子数的3倍 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
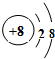 .
.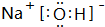 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com