
某同学用如下图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用下图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再变澄清的现象,且通入SO2产生现象明显比通入CO2快。
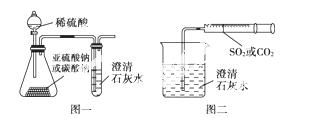
(1)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是________________________________________________________________________。
(2)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊、澄清的现象比CO2快的原因是_______________________________________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度 考虑装置应做何改进?_____________________________________________________________________。
考虑装置应做何改进?_____________________________________________________________________。
科目:高中化学 来源: 题型:
容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g) xC(g) △H<0。测得两容器中c(A)随时间t的变化如右图所示,下列说法错误的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如右图所示,下列说法错误的是
A.甲容器中A的反应速率为0.1mol/L·min
B.给甲容器加压可缩短反应达到平衡的时间
C.给乙容器升温可缩短反应达到平衡的时间
D.甲和乙的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某铜粉样品含少量金(Au),不含其他成分。测定该样品中金的含量时,有两种溶解样品的方法:①用稀硝酸溶解样品,②用双氧水和稀盐酸溶解样品,其反应的化学方程式为:Cu+H2O2+2HCl===CuCl2+2H2O。
已知金不与稀硝酸、双氧水和盐酸反应。
(1)写出铜与稀硝酸反应的离子方程式: ____________________________________
__________________。
(2)在铜与双氧水和稀盐酸的反应中氧化剂是________,若有2 mol的H2O2参加反应,则转移电子的物质的量是________。
(3)方法①和②相比较,你认为哪种更好?理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.浓硫酸稀释时,应将水沿器壁慢慢 倒入浓硫酸中,并不断用玻璃棒搅拌
倒入浓硫酸中,并不断用玻璃棒搅拌
B.浓硫酸不分解,不挥发,所以可以敞口放置于空气中
C.浓硫酸具有氧化性,稀硫酸无氧化性
D.可以用铁罐或铝槽车来运输冷的浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
有关亚硫酸的下列叙述中不正确的是( )
A.亚硫酸是SO2的水溶液,显酸性
B.SO3溶于水,剧烈反应生成亚硫酸
C.亚硫酸具有漂白性,能够使品红溶液褪色
D.亚硫酸不稳定,易分解为水和SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器中
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上由黄铜矿(主要成分 为CuFeS2)冶炼铜的主要流程如下:
为CuFeS2)冶炼铜的主要流程如下:
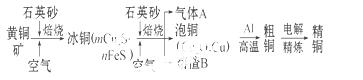
(1)气体A中的大气污染物可选用下列试剂中的 吸收。
a.浓硫酸 b.稀硝酸
c.NaOH溶液 d.氨水
(2)用稀硫酸浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),
检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c. 溶液中Cu2+向阳极移动
溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
| X | ||
| Y | Z | W | |
A.最高价氧化物对应水化物的酸性Y>Z>W
B.含Y元素的盐溶液一定显酸性
C.原子半径:rW>rZ>rY>rX
D.X与W的气态氢化物可相互反应生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料。在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷。

制备时的化学反应方程式及有关数据如下:
NaBr+H2SO4=HBr+NaHSO4
C4H9OH+HB rC4H9Br+H2O
rC4H9Br+H2O
| 物质 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
实验步骤:在装置A中加入2mL水,并小心加入28mL浓硫酸,混合均匀后冷却至室温。再依次加入18.5mL正丁醇和26g溴化钠,充分摇振后加入沸石,连接气体吸收装置C。将装置A置于石棉网上加热至沸腾,然后调节为小火使反应物保持平稳地回流。一段时间后停止加热,待反应液冷却后,拆去装置B,改为蒸馏装置,蒸出粗正溴丁烷。
请回答下列问题;
(1)仪器A的名称是________,仪器B的作用是________.操作中加入沸石的作用是________.
(2)装置C中盛装的液体是_______________,其作用是____________________.
(3)制备的粗产物正溴丁烷中往往含有水分、正丁醇等杂质,加入干燥剂出去水分后,再由下列操作中的___________制备纯净的正溴丁烷。
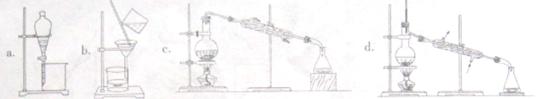
(4)若制备实验的“回流”过程中不采用“调节为小火”,仍采用大火加热回流,则会使产品产率偏_________(填“高”或“低”),试说出其中一种原因:_________________________.
(5)若最终得到13.6g纯净的正溴丁烷,则该实验的产率是_______________(保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com