

| 离子 | 开始沉沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
| ||
| ||


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| A、pH=2的盐酸与pH=12的氨水等体积混合:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| B、0.2 mol?L-1的CH3COONa溶液与0.1 mol?L-1的HCl等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
| C、0.1 mol?L-1的HCN(弱酸)和0.1 mol?L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)=c(Na+)+c(H+) |
| D、相同物质的量浓度时,溶液中c(NH4+)由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某原电池结构如右图所示,下列有关该原电池的说法正确的是( )
某原电池结构如右图所示,下列有关该原电池的说法正确的是( )| A、铜棒为负极 |
| B、镁棒发生还原反应 |
| C、电子从铜棒经外电路流向镁棒 |
| D、电池反应为Mg+2H+=Mg2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 100℃ | |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 110.0 | 169 | 246 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 45.5 | 51.1 | 56.7 |
| NaNO3 | 73 | 80 | 88 | 96 | 104 | 124 | 148 | 180 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | 39.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

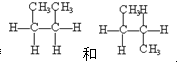


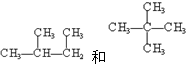




查看答案和解析>>
科目:高中化学 来源: 题型:
 下列物质A~F是我们熟悉的单质或化合物,其中A是一种常见的金属;B常温下是黄绿色气体;单质C含有的元素是位于元素周期表中第一周期ⅠA族; E是无色溶液.在适当的条件下,它们可以按下面框图进行反应.
下列物质A~F是我们熟悉的单质或化合物,其中A是一种常见的金属;B常温下是黄绿色气体;单质C含有的元素是位于元素周期表中第一周期ⅠA族; E是无色溶液.在适当的条件下,它们可以按下面框图进行反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其他条件不变时,升高温度,化学反应速率加快 |
| B、其他条件不变时,增大浓度,化学反应速率加快 |
| C、化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 |
| D、化学反应达到反应限度时,正反应的速率与逆反应的速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com