
| A.原子半径:Z>Y>X | B.Z与X在同一周期 |
| C.氢化物的稳定性:X>Y | D.XZ4属于共价化合物 |
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源:不详 题型:单选题
| A.随原子序数逐渐增大,单质跟水的反应能力逐渐减弱 |
| B.随原子序数逐渐增大,单质的氧化性逐渐减弱 |
| C.将氯水加到KI-淀粉溶液中,溶液变蓝 |
| D.随原子序数逐渐增大,氢化物的稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的说法,错误的是
的说法,错误的是
| A.是两种原子 | B.互为同位素 |
| C.中子数分别为176和177 | D.电子数相差1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电子云就是电子运动的形态 |
| B.焰色反应产生的是发射光谱 |
| C.铜原子处于基态时的核外电子排布式为3d104s1 |
| D.核外电子运动状态可以用牛顿运动定律来描述,也可以用统计方法来描述 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
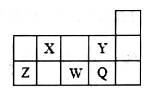
| A.元素的非金属性Y>Q,但其同浓度氢化物水溶液的酸性,HY<HQ |
| B.形成简单离子的半径从小到大的顺序是Y<Q<W |
| C.Z的最高价氧化物可溶于水,也能溶于强碱溶液 |
| D.X的气态氢化物浓溶液可用于检验管道氯气的泄漏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com