
| | 操作 | 现象 | 结论 |
| A | 用CH3COOH溶液浸泡水垢 | 水垢溶解,有无色气泡 | 酸性:CH3COOH>H2CO3 |
| B | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| C | 向FeBr2溶液中通入过量Cl2 | 溶液由浅绿色变成黄色 | 氧化性:Br2>Fe3+ |
| D | 用石墨电极电解滴有酚酞的饱和NaCl溶液 | 在阴极附近溶液呈现红色 | 离子移动方向:OH-移向阴极 |
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:不详 题型:实验题
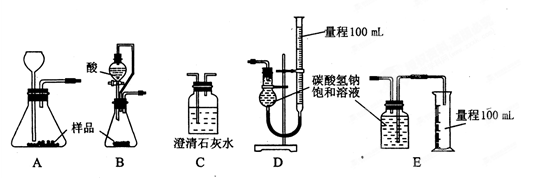
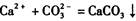 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用食盐水除水垢 |
| B.用加热的方法给聚乙烯塑料袋封口 |
| C.用铅笔芯代替石墨试验导电性 |
| D.用灼烧的方法区别羊毛线和棉线 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验操作 | 实验目的 |
| A | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠中含有醛基 |
| B | 向苯酚的饱和溶液中滴加稀溴水 | 验证三溴苯酚为白色沉淀 |
| C | 向酒精和乙酸的混合液中加入金属钠 | 确定酒精中混有醋酸 |
| D | 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的溴离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某固体加入稀盐酸,产生无色且使澄清石灰水变浑浊的气体,证明该固体一定含CO32- |
| B.检验烧碱溶液中是否含Cl-,先加稀盐酸,再加AgNO3溶液,产生白色沉淀 |
C.某溶液中滴加BaCl2溶液,再加稀HNO3,产生白色沉淀,原溶液中一定含SO |
| D.某溶液中滴入KSCN溶液无明显变化,再加入氯水呈红色,原溶液中一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3 |
B.向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液的SO - - |
| C.用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 |
| D.先后添加酚酞试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 要的用途,分别是 和 ;
要的用途,分别是 和 ; 色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。
色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。| 溶质 | 加入试剂 | 离子方程式 |
| Cu2+ | | |
| SO42- | | |
 液浓度将
液浓度将  ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com