
下列说法正确的是
A.1L 1mol?L-1的NH4Cl溶液中一定含有NA个NH4+
B.常温常压下,22.4L乙烯中含共价键数为5 NA
C.6.8g熔融的KHSO4中含有0.05 NA个阳离子
D.1mol冰醋酸和lmo1乙醇在浓硫酸加热下反应可生成NA个H2O
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
氯碱工业常利用阳离子交换膜电解食盐水,下列说法不正确的是
A.随着电解的进行,c(NaCl)降低,需不断补充饱和食盐水
B.电解过程中采用增大阳极区溶液pH的方法,可以减少Cl2在水中的溶解量
C.阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集
D.阳极表面用钛氧化物涂层处理,目的是降低电解产物Cl2对电极的腐蚀
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期。A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白
(1)元素的第一电离能最大的是________, 属于过渡元素的是________(填写元素符号)
(2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。
(3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。
(5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。
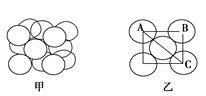
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:简答题
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mo l。
l。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为
 (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:

① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如右图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.c(H+)=c(CHCOO-)+c(OH-)
B.加入少量CH3COONa固体后,加入,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
北京时间2012年9月14日,国外媒体报道,美国宇航局的“好奇”号火星车已经展开它的X射线分析器,并首次完成对火星物质元素成分的分析。下面这张图显示的是α粒子与X射线分光仪从某仪器获得的元素分析数据。多个峰值表明各种成分非常丰富,其中包括在火星大气里发现的氩,该仪器自身的铝,以及火星土壤微粒所含的硫黄和氯.
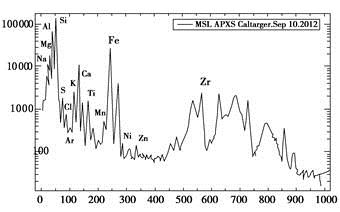
理解此图,判断下列说法错误的是
A.峰值最高的过渡元素在周期表中的位置是第四周期第Ⅷ副族
B.上述元素分析图中,同一周期的两种主族元素可形成1∶1型离子化合物只有一种,其电子式为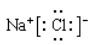
C .氯比硫的非金属性强的依据之一是HCl比H2S稳定
D.工业上常用电解氧化铝的方法制备铝
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
在20 mL 0.1mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是

A.溶液??性时,回滴加入适量的NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.C点时其pH=5.6,溶质恰好为等物质的量CH3COONa和CH3COOH,则溶液中微粒浓度关系为:c(Na+)>c(CH3COO-)
C.在B点,a>20,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
D.在D点:c(CH3COOH)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
对以下问题的认识中,不正确的是
A.质谱法是用高能粒子束轰击有机物分子,使之分离成带电的“碎片”,并根据其特征谱分析有机物结构的方法
B.丁达尔效应可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔效应
C.谷氨酸(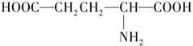 )的熔点高达205℃,难溶于苯等有机溶剂,主要是因为形成内盐
)的熔点高达205℃,难溶于苯等有机溶剂,主要是因为形成内盐
D.“地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余废物合理利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com