
| A. | 2:1 | B. | 3:2 | C. | 2:3 | D. | 1:1 |
分析 把铝粉和Fe2O3粉末配成铝热剂,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,由反应方程式可知生成n(Fe)=n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知,n(H2)=n(Fe);令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),据此计算判断.
解答 解:把铝粉和Fe2O3粉末配成铝热剂,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,由反应方程式可知生成n(Fe)=n(Al),所以n(H2)=n(Al);
令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),所以n′(H2)=$\frac{3n}{2}$n(Al).
故两种情况下生成气体的物质的量之比为n(H2):n′(H2)=n(Al):$\frac{3n}{2}$n(Al)=2:3,
故选C.
点评 本题考查混合物的计算、根据方程式的计算,难度中等,本题采取电子转移守恒计算,比根据方程式简单容易,清楚反应过程是关键,注意混合物的计算中守恒的运用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CO32-、Cl-、Na+、H+ | B. | Al3+、K+、OH-、SO42- | ||
| C. | Ba2+、NO3-、SO42-、H+ | D. | K+、Al3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
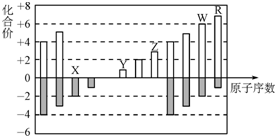
| A. | 离子半径:X>Y>Z | |
| B. | WX3和水反应形成的化合物是离子化合物 | |
| C. | 最高价氧化物对应的水化物酸性:R>W | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
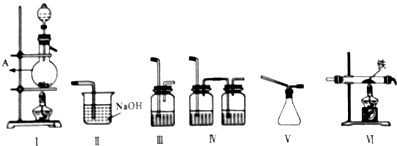
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力、范德华力、氢键 | B. | 范德华力、范德华力、共价键 | ||
| C. | 共价键、共价键、共价键 | D. | 范德华力、氢键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com