


科目:高中化学 来源: 题型:
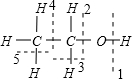 ,则乙醇完全燃烧时,可能不断裂的键是:
,则乙醇完全燃烧时,可能不断裂的键是: ②CH2=CH2 ③CH≡CH ④
②CH2=CH2 ③CH≡CH ④ ⑤
⑤
 ⑦
⑦ 中属于芳香烃的是
中属于芳香烃的是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
| 22.4bc |
| aNA |
| 22.4bc |
| aNA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 物质 | 试剂名称或化学式 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:SiO2(CaCO3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:Na2CO3 Na2SiO3 Na2SO3溶液 | |
| ⑤ | 鉴别:(NH4)2SO4 NH4Cl Na2SO4溶液 |
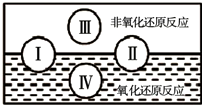
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com