
I.过氧化钡常温下缓慢分解,不溶于水,常用作氧化剂、漂白剂等。请回答:
(1)BaO2的电子式为__________。
(2)BaO2在有水存在下,通过与二氧化碳作用,分解生成过氧化氢,其化学反应方程式为__________。
(3)BaCl2在氨水中与H2O2反应可得到BaO2沉淀,用一个离子反应方程式表示其原理__________。
(4)配平下列反应方程式:
( )MnO4- + ( )BaO2 + __________= ( )Ba2++( )Mn2+ + __________+( )H2O
Ⅱ、2.38g化合物甲,在空气中充分煅烧后,得固体残留物乙1.82g和标准状况下896mL气体A,该气体能使品红溶液褪色,加热后品红溶液恢复至原色。所得固体残留物乙能全部溶于稀硫酸得溶液B,能部分溶于NaOH溶液中得溶液C和0.8g残留物D。取少量溶液B,滴加KSCN溶液,发现溶液变为血红色。
请推测并回答:
(1)用离子反应方程式解释溶液变为血红色的原因:__________。
(2)写出形成溶液C的化学方程式:__________。
(3)写出气体A通入溶液B中,发生氧化还原的离子反应方程式:__________。
(4)写出化合物甲的化学式__________。
(5)有人认为:化合物甲中部分元素所形成的合金,在气体A中可逐渐形成化合物甲,试从氧化还原的角度,分析该说法的合理性:__________。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源:2016届西藏日喀则一中高三下学期二模考试理综化学试卷(解析版) 题型:实验题
某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究.为测定黄铜矿中硫元素的质量分数,将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品.
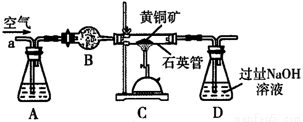
(1)锥形瓶A内所盛试剂是__________;装置B的作用是__________;锥形瓶D内发生反应的离子方程式为__________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:
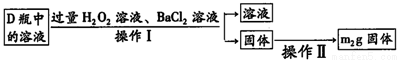
如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为__________;操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法__________;该黄铜矿中硫元素的质量分数为__________(用含m1、m2的代数式表示).
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是__________
A.KSCN溶液、氯水 B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液 D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+.设计实验方案验证泡铜中是否含有Cu2O__________。
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古赤峰二中高三第四次模拟理综化学试卷(解析版) 题型:选择题
芳香族化合物A与 互为同分异构体,A苯环上的一氯代物只有一种结构,则A可能的结构有( )
互为同分异构体,A苯环上的一氯代物只有一种结构,则A可能的结构有( )
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
甲、乙两种金属:①甲比乙容易与H2O反应;②甲单质能与乙的阳离子发生置换反应;③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强;④与某非金属反应时,甲原子失去的电子数目比乙多;⑤甲与乙作为电极材料,盐酸做电解质溶液构成原电池,甲为正极。能说明甲比乙的金属性强的是( )
A.①③④ B.①③④⑤
C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
实验室常用H2O2制取O2,下列说法不正确的是( )
A.H2O2分子中含有极性键和非极性键
B.向其溶液加入少量MnO2和FeCl3等能加快反应
C.H2O2分子中所有原子都达8电子结构
D.该反应中H2O2是氧化剂也是还原剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
将盛有N2和NO2(无N2O4)混合气体的试管倒立于水中,经过足够长的时间后,试管内气体的体积缩小为原来的一半,则原混合气体中N2和NO2的体积比是( )
A.1:1 B.1:2 C.1:3 D.3:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
下列说法错误的是( )
A.附着在试管内壁上的AgOH固体可用氨水溶解而洗去
B.可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液
C.向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液
D.加热碘单质,产生紫色蒸气,这个过程克服了范德华力
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D.②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:实验题
能源、环境与人类的生活和社会发展密切相关。低碳、环保,能源的综合利用是是当今的热门话题。英国蒂斯河畔斯托克顿市的“空气燃料合成公司冶竟真的发明出了一种将空气变成汽油的高科技技术,而美国科学家最早设计出以甲烷等碳氢化合物为燃料的新型电池,大大提高天然气的利用效率。据此,回答下列问题:
(1)“空气变汽油”这项科技解决环境问题的意义是_______________________;
(2)“空气变汽油”其原理可简化如下:
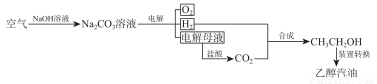
则:
①合成路线中,NaOH 和盐酸都可以循环利用,写出有关反应式______________________;
②转变过中,100g5%Na2CO3溶液,电解后,溶液浓度变为10%,则生成标准状况下的氢气多少升?
(3)天然气燃料电池最大的障碍是氧化反应不完全,产生________ (填写化学式)堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间。
(4)以下是天然气燃料电池电解精炼铜的装置图:
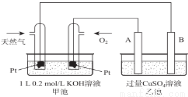
则,①甲池反应的离子方程式为______________________;
②当乙池中某电极的质量增重12.8g 时,理论上甲池中消耗的CH4在标准状况下的体积为__________mL,甲池中溶液的pH约为__________(溶液的体积变化忽略不计);此时向甲池中加入1 L1.0×10-3mol/L的CaCl2溶液,则甲池中________(填“有”或“无”)沉淀生成[已知Ksp(CaCO3)=2.9×10-9]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com