
下列关于离子共存或离子反应的说法正确的是
A. 某无色溶液中可能大量存在:H+、Cl-、MnO4-
B. 室温下由水电离的 c(OH-)=1×10-12mol·L-1的溶液中能大量共存:K+、Na+、Cl-、HCO4-
C. 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl-
D. 稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-===BaSO4↓+H2O
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2016-2017学年湖北省襄阳市高二3月月考化学试卷(解析版) 题型:简答题
PCT是一种新型聚酯材料,下图是某研究小组合成PCT的路线。
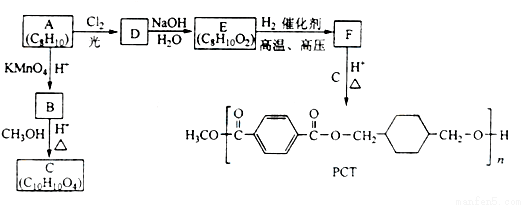
请回答下列问题:
(1)由A生成D的化学方程式为________________________
(2)由A生成B的反应类型是________________
(3)由E生成F的化学方程式为_______________________
(4)B的同分异构体中,能发生水解反应,且苯环上一氯代产物只有一种的是________________(写结构简式)。
(5)D的同分异构体中苯环上有三个取代基的芳香化合物有__________种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省益阳市高一下学期3月月考化学试卷(解析版) 题型:计算题
把主族元素X的最高价氧化物X2O 4.7g溶于95.3g水中,得到溶质质量分数为5.6%的溶液,Y与X位于同一族,12gY的氢氧化物与400mL0.75
molL-1的盐酸完全中和,Z与Y同周期,标准状况下5.6L ZO2 为16g。则
(1)X的相对原子质量为__________________;
(2)Y的氧化物为_______化合物;
(3)Z的最高价氧化物的水化物化学式为____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省益阳市高一下学期3月月考化学试卷(解析版) 题型:选择题
某元素的二价阳离子(R2+)核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( )
A. 18 B. 20 C. 16 D. 22
查看答案和解析>>
科目:高中化学 来源:2017届宁夏银川市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:简答题
(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g) + 2H2(g) CH3OH(g),在体积为1L的恒容密闭容器中,充人2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充人2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
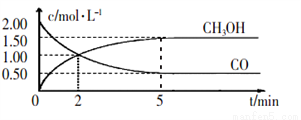
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=______________
②下列说法正确的是___________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充人氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g) SO3(g)+NO(g) , 达到平衡时SO3的体积分数为25%。该反应的平衡常数K = _________。
SO3(g)+NO(g) , 达到平衡时SO3的体积分数为25%。该反应的平衡常数K = _________。
(3)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H= +131.0kJ/molZiyuanku.com
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= -43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= -178.3kJ/mol
计算①反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=_________kJ/mol;
CaCO3(s)+2H2(g)的△H=_________kJ/mol;
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是_________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是_________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
(4)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_________________。
(5)若往20 mL0.01mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是________(填标号)
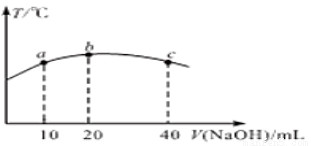
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一下学期3月月考化学试卷(解析版) 题型:实验题
某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾粒,观察现象。
甲同学设计实验的目的是_____________________________________。反应最剧烈的烧杯是________(填序号)。
(Ⅱ)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性越强。他设计了右图所示装置以验证氮、碳、硅元素的非金属性强弱。
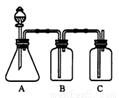
(1)已知仪器A中放一种块状固体,打开分液漏斗的活塞后,A中可观察到的现象是___________;C中可观察到的现象是_____________。
(2)仪器B盛放的试剂是______________________,其作用是_________________。
(3)分别写出A、B、C中发生反应的离子方程式______________、_______________、________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一下学期3月月考化学试卷(解析版) 题型:选择题
在一定条件下,RO3n-和I-发生反应的离子方程式为:RO3n-+6I-+6H+=R-+3I2+3H2O,则RO3n-中R元素的化合价及R在元素周期表中的位置是( )
A.+5价,ⅦA族 B.+5价,ⅤA族
C.+7价,ⅦA族 D.+7价,ⅤA族
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一下学期3月月考化学试卷(解析版) 题型:选择题
下列说法正确的是:
A. P和S属于第三周期元素,P原子半径比S小
B. Na和Rb属于第ⅠA族元素,Rb失电子能力比Na强
C. C和Si属于第ⅣA族元素,SiH4比CH4稳定
D. Cl和Br属于第ⅦA族元素,HClO4酸性比HBrO4弱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高二下学期开学考试化学试卷(解析版) 题型:填空题
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式____________________。
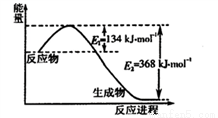
(2)已知:
N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=________kJ·mol-1。
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g) 2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________(计算结果保留一位小数)。
2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________(计算结果保留一位小数)。
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g) 2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1_________K2(填写“>”、“=”或“<”)
2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1_________K2(填写“>”、“=”或“<”)
T/K | 298 | 398 | 498 |
平衡常数K | 51 | K1 | K2 |
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是____(填字母)
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com