
| A. | 测定某二元弱酸钠盐溶液的pH,可能小于7 | |
| B. | 稀释0.1mol/LCH3COOH(aq),$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可能变大也可能变小 | |
| C. | 在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml | |
| D. | pH=8的碱性溶液中一定没有CH3COOH分子 |
分析 A、NaH2PO4溶液显酸性;
B、醋酸溶液加水稀释,氢离子浓素减小,氢氧根离子浓度增大,电离平衡常数不变,对式子进行变形可得;
C、在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液20.00mL时,恰好中和,溶液显碱性;
D、醋酸钠溶液显碱性,存在醋酸分子.
解答 解:A、多元弱酸的酸式盐,可能显酸性,如NaH2PO4,故A正确;
B、醋酸溶液加水稀释,氢离子浓度减小,氢氧根离子浓度增大,电离平衡常数不变,无法判断$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{c({OH}^{-})c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c({H}^{+})c(C{H}_{3}COOH)}$=$\frac{c(O{H}^{-})}{c({H}^{+})}$•Kw,Kw只跟温度有关,因此$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$一定增大,故B错误;
C、在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液20.00mL时,恰好中和生成NaCl和CH3COONa的混合溶液,醋酸钠溶液水解使溶液显碱性,若pH=7,NaOH溶液体积一定小于20.00ml,故C正确;
D、醋酸钠溶液显碱性,水解生成醋酸分子,故D错误;
故选AC.
点评 本题考查了多元弱酸的酸式根离子既电离也水解、醋酸加水稀释时离子浓度变化、盐类水解,题目难度不大.


科目:高中化学 来源: 题型:解答题
 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形.
、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形. ,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.
,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.
已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.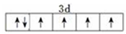 ;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.
;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.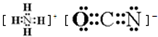 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察放入金属Na是否产生气泡 | |
| B. | 观察滴入的紫色石蕊溶液是否变红 | |
| C. | 观察滴入的酸性KMnO4溶液是否褪色 | |
| D. | 观察插入的表面发黑的灼热铜丝是否变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 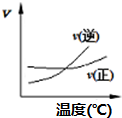 A2(g)+3B2(g)?2AB3(g)如图说明此反应的正反应是吸热反应 | |
| B. | 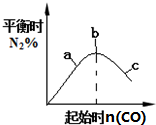 4CO(g)+2NO2(g)?N2(g)+4CO2(g)如图说明NO2的转化率b>a>c | |
| C. |  N2(g)+3H2(g)?2NH3(g)如图说明t秒时合成氨反应达到平衡 | |
| D. |  2A(g)+2B(g)?3C(g)+D(?)如图说明生成物D一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、C
、C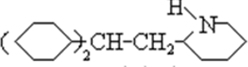 .
.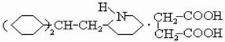 .
.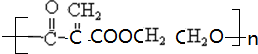 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 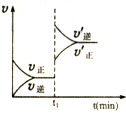 表示某吸热反应t1时刻升高温度时,正逆反应速率的变: | |
| B. | 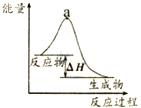 表示某放热反应过程的能量变化,若使用催化剂,a点会降低 | |
| C. | 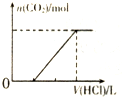 表示向含等物质的量的NaOH、Na2CO3混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 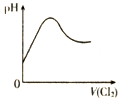 表示Cl2通入H2SO3溶液中pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铀原子的中子数为238 | |
| B. | 铀原子的中子数与质子数之差为142 | |
| C. | 铀原子的电子数为92 | |
| D. | 92235U与92238U互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com