
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶
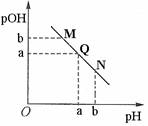 液,溶液中pOH [ pOH=-lg(OH—) ]与pH的变化
液,溶液中pOH [ pOH=-lg(OH—) ]与pH的变化
关系如图所示,则下列说法正确的是
A.M点所示溶液导电能力强于Q点
B.M点和N点所示溶液中水的电离程度相同
C. N点所示溶液中c(CH3COO-)>c(Na+)
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5NA
B.4.2 g丙烯中所含的共用电子对总数为0.6NA
C.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA
D.在高温、高压、催化剂的条件下,28gN2和6gH2充分反应,生成NH3的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。
(1)由图中所给数据进行分析,该反应的化学方程式为 。
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为_______。
(3)达到平衡是X的浓度是 ;
(4)当反应进行到第 min,该反应达到平衡。反应达到平衡后,下列措施能加快化学反应速率的有_____________
A.增大反应物的浓度 B.升高温度 C.使用正催化剂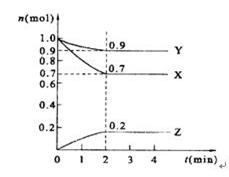
查看答案和解析>>
科目:高中化学 来源: 题型:
奥运会会标是五环旗,假定奥运五环旗中的每一环或每种颜色表示一种物
质,相连的环(物质)间一定条件下能发生反应,
 且四种反应中必须包含化合反应、置换反应及复
且四种反应中必须包含化合反应、置换反应及复
分解反应,则适合的一组是
| 选项 | 蓝 | 黄 | 黑 | 绿 | 红 |
| A | SO2 | H2S溶液 | FeCl3溶液 | Fe | CuSO4溶液 |
| B | O2 | Cu | 稀HNO3 | NaOH溶液 | CO2 |
| C | Cl2 | NH3·H2O | 稀H2SO4 | NaOH溶液 | Al(OH)3 |
| D | N2 | Mg | CO2 | CaO | 稀HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入
前者,反应现象相同的是
A.FeSO4和酸性KMnO4 B.AlCl3和NaOH
C.Na2CO3和HCl D.Ca(HCO3)2和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为摇摆电池的工作原理图,在充放电过程中Li+在两极间“摇来摇去”,其总反应为:LiCoO2+6C  Li(1-x)CoO2+ LixC6 下列有关说法正确的是
Li(1-x)CoO2+ LixC6 下列有关说法正确的是
 A. 放电时,负极反应为:
A. 放电时,负极反应为:
LiCoO2—= Li(1-x)CoO2 + xLi+
B. 充电时,B极发生还原反应
C. 充电时,Li+穿过隔离膜向B极移动
D. 当A极得到x mol电子,电池消耗6 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时弱电解质电离平衡常数:Ka(CH3COOH)=1.8×10—5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L的HSCN溶液
分别与0.10 mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积V
与时间t的关系如图甲所示:


反应开始时,两种溶液产生CO2的速率明显不同的原因是____________
_________________________________________________;反应结束后所得溶液中c(SCN—)______c(CH3COO—) (填“>”、“=”或“<”)。
(2)2.0×10—3 mol/L的HF水溶液中,调节溶液pH(忽略调节pH时溶液的
体积变化),测得平衡体系中c(F—)、c(HF)与溶液pH的关系如图乙所示。
则25℃时,HF电离平衡常数为Ka(HF)=_____________________________
______________________(列式并求值,不写单位)。
(3)难溶物CaF2溶度积常数(Ksp)= 1.5×10—10,将4.0×10—4mol/L的HF溶液
与4.0×10—4mol/L的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节
pH时溶液的体积变化),试分析混合后是否有沉淀生成?________(填“有”
或“没有”),简述理由:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ▲ ,试样的pH= ▲ 。
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是 ▲ (填字母)。
a. Ca(OH)2 b. Na2CO3 c. CaCl2 d. NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 ▲ 。
2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 ▲ 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g) 2C(s)+O2(g)。
2C(s)+O2(g)。
已知该反应的ΔH>0,简述该设想能否实现的依据 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值。下列说法正确的是 ( )。
A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1 NA
B.常温常压下,18 gH2O中含有的原子总数为3 NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5 NA
D.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1  NA
NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com