
| A. | 氢氧化钠的电子式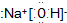 | |
| B. | 质子数为29、中子数为35的铜原子${:}_{29}^{35}$Cu | |
| C. | 氯离子的结构示意图: | |
| D. | 对苯二酚的结构简式: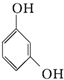 |
分析 A、离子化合物阴离子带电荷且用“[]”,在右上角报上所带的电荷数;
B、元素符号左上角标质量数,左下角标质子数,而质量数=质子数+中子数;
C、氯离子的最外层有8个电子;
D、对苯二酚中的两个-OH为对位结构.
解答 解:A.NaOH为离子化合物,由钠离子和氢氧根构成,故其电子式为: ,故A正确;
,故A正确;
B、元素符号左上角标质量数,左下角标质子数,而质量数=质子数+中子数,故质子数为29、中子数为35的铜原子6429Cu,故B错误;
C、氯离子是在氯原子的基础上得到一个电子,故最外层有8个电子 ,故C错误;
,故C错误;
D、对苯二酚中的两个-OH为对位结构,此物质为间苯二酚,故D错误.
故选A.
点评 本题考查了化学用语的表示方法,题目难度中等,注意掌握电子式、离子结构示意图等化学用语的概念及书写原则,试题有利于提高学生的规范答题的能力.


科目:高中化学 来源: 题型:解答题
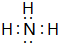 ,结构式为
,结构式为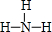 ,写出D的气态氢化物在催化剂存在下跟氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,写出D的气态氢化物在催化剂存在下跟氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 | |
| C. | CO2与SiO2晶体熔化时,所克服的微粒间相互作用不同 | |
| D. | 短周期元素离子aXn-和bYm-具有相同的电子层结构,若a>b,则n>m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe,Cl2 | B. | C,O2 | C. | N2,O2 | D. | S,O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,nCH2=CH-CH=CH2$\stackrel{催化剂}{→}$
,nCH2=CH-CH=CH2$\stackrel{催化剂}{→}$ ,nCH2=CH-CH=CH2$\stackrel{催化剂}{→}$
,nCH2=CH-CH=CH2$\stackrel{催化剂}{→}$
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | M一定不是酸 | B. | X2+一定是金属离子 | ||
| C. | Y-是OH- | D. | M是一定属于盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com