
下列说法正确的是
油脂在酸性条件下水解的反应称为皂化反应
B.煤的炼制方法中煤的气化和液化是物理方法,煤的干馏是化学方法
C.石油裂化的目的是提高轻质油的产量和质量
D.蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。
[方案一]
[实验方案] 将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_______________________________。
[实验步骤]
(1)称取10.8 g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0 mol·L-1的NaOH溶液中,充分反应。则NaOH溶液的体积V≥__________mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______________(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案] 将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用下列实验装置完成实验:
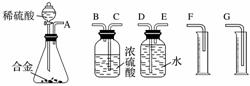
你认为最简易的装置其连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满)。

(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
①装置中导管a的作用是_____________________________________;
②实验前后量气管中液面读数分别为V1 mL、V2 mL,则产生氢气的体积为__________mL;
③若需确定产生氢气的量,还需测定的数据是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH=1的溶液中可以大量共存的离子组是( )
A.K+、Na+、SO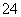 、S2-
、S2-
B.NH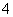 、Mg2+、SO
、Mg2+、SO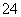 、Cl-
、Cl-
C.Na+、K+、HCO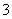 、Cl-
、Cl-
D.K+、Na+、[Al(OH)4]-、NO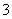
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,2.24 L水中所含电子总数为NA
B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO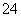 数目为0.6NA
数目为0.6NA
C.1 mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA
D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于加成反应的是
A.乙醇与乙酸在浓硫酸加热条件下反应
B.乙烯通入溴的四氯化碳溶液
C.苯与浓硝酸、浓硫酸的混合物共热
D.乙醇在铜粉存在下与氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度和压强下,在容积为2 L的密闭容器中发生反应:2HI(g) H2(g)+I2(g),达到平衡状态的标志是
H2(g)+I2(g),达到平衡状态的标志是
A.c(H2)保持不变
B.拆开2 mol H-I共价键,同时生成1 mol H-H共价键
C.HI、H2、I2的浓度比为2:1:1
D.正反应和逆反应都已停止
查看答案和解析>>
科目:高中化学 来源: 题型:
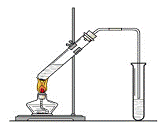 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)浓硫酸的作用是:① ;② 。
(3)饱和碳酸钠溶液的主要作用是
。
装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是 。
若要把制得的乙酸乙酯分离出来,应采用的实验操作是
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素只存在2种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63.下列叙述错误的是( )
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
将2 mol I2(g)和1 mol H2置于某2 L的密闭容器中,在一定温度下发生反应:I2(g)+H2(g)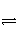
 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
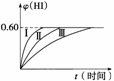
(1)达到平衡时,I2(g)的物质的量浓度为__________。
(2)若改变反应条件,在甲条件下φ(HI)的变化如图曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是________(填入下列条件的序号,下同),乙条件可能是__________。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com