
 ,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).
,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).分析 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,则W为N元素、Y为S元素;X的基态原子核外有7个原子轨道填充了电子,且原子序数大于W,而小于Y,核外电子排布为1s22s22p63s23p1,所以X是Al元素;Z的基态原子核外有1个单电子,它的一种化合物常用来检验葡萄糖,则Z为Cu.
解答 解:W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,则W为N元素、Y为S元素;X的基态原子核外有7个原子轨道填充了电子,且原子序数大于W,而小于Y,核外电子排布为1s22s22p63s23p1,所以X是Al元素;Z的基态原子核外有1个单电子,它的一种化合物常用来检验葡萄糖,则Z为Cu.
(1)X为Al,核外电子排布为1s22s22p63s23p1,位于元素周期表第三周期第ⅢA族.非金属性越强,第一电离能越大,故第一电离能S>Al,
故答案为:三、ⅢA;大;
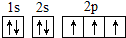
(2)W为N元素,基态核外电子排布为1s22s22p3,基态原子核外电子排布图是 ,由于氮元素非金属性比氧的弱,故W(氮)的气态氢化物稳定性比H2O(g)弱,
,由于氮元素非金属性比氧的弱,故W(氮)的气态氢化物稳定性比H2O(g)弱,
故答案为: ;弱;
;弱;
(3)Y的最高价氧化物对应水化物为硫酸,Cu与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
点评 本题考查结构由位置关系、核外电子排布、电离能、元素化合物等知识,能正确判断各元素是解本题的关键,注意基态原子核外电子排布式要遵循构造原理.


科目:高中化学 来源: 题型:选择题
| A. | ②⑥ | B. | ③④⑤⑥ | C. | ③④⑥ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  1,4-二甲基丁烷 | B. | 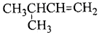 3-甲基丁烯 | C. | 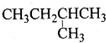 2-甲基丁烷 | D. | 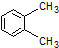 二甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
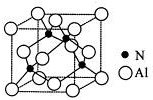
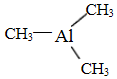 ,则其中铝原子的杂化方式为sp2.若氮化铝可由(CH3)3Al 和 NH3在一定条件下反应制得,反应的方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与取代反应有机反应类型相似(填反应名称).
,则其中铝原子的杂化方式为sp2.若氮化铝可由(CH3)3Al 和 NH3在一定条件下反应制得,反应的方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与取代反应有机反应类型相似(填反应名称).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试剂 | 离子反应方程式 | |
| ①NaHCO3溶液(Na2CO3) | CO2 | CO2+H2O+CO32-=2HCO3- |
| ②Fe2O3(Al2O3) | NaOH溶液 | Al2O3+2OH-=2AlO2-+H2O |
| ③FeCl3溶液(FeCl2) | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| ④CO2(HCl) | 饱和的NaHCO3溶液 | HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源 | |
| B. | 煤是由多种有机化合物组成的混合物,内含煤焦油等成分 | |
| C. | 煤除了含有C、H元素外,还含有少量的N、S、O等元素 | |
| D. | 煤等化石燃料的储量有限,节能和开发新能源是人类实现可持续发展的关键之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com