
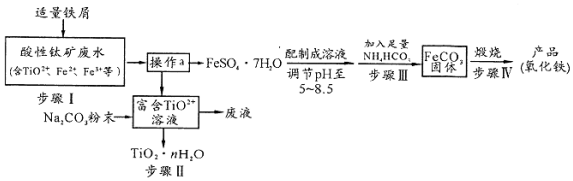
分析 钛矿工业中的酸性废水富含Ti、Fe等元素,含有TiO2+、Fe2+、Fe3+等离子,加入铁粉还原铁离子得到亚铁离子,通过蒸发浓缩、冷却结晶过滤洗涤、干燥得到硫酸亚铁晶体,配制成溶液调节溶液PH5-5.8范围内,加入足量碳酸氢铵,过滤得到碳酸亚铁沉淀,在坩埚中灼烧得到氧化铁,过滤后得到富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,以此解答该题.
(1)离子中个元素化合价代数和等于离子所带电荷数计算,元素为-2价;
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是检验是否含铁离子;
(3)溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶过滤洗涤、干燥;
(4)步骤Ⅲ中发生反应是硫酸亚铁和碳酸氢铵反应生成碳酸亚铁沉淀、硫酸铵、二氧化碳和水,反应温度一般需控制在35℃以下,是为了避免温度过高碳酸氢铵分解,减少铁离子的水解程度;
(5)根据溶液中c(Fe2+)•c(OH-)2与Ksp[Fe(OH)2]比较,可判断有无Fe(OH)2沉淀,保证二价铁被氧化为三价需要多通入空气或氧气;
(6)富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动
解答 解:(1)离子中个元素化合价代数和等于离子所带电荷数计算,元素为-2价,则TiO2+钛的化合价为+4价,
故答案为:+4;
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是检验是否含铁离子,可以选择加入KSCN溶液,溶液变红色证明铁加入不足,如溶液不变红色证明铁粉加入足量,
故答案为:KSCN溶液;
(3)操作a是溶液中得到溶质固体,方法是蒸发浓缩、冷却结晶过滤洗涤、干燥,
故答案为:过滤洗涤、干燥;
(4)步骤Ⅲ中发生反应是硫酸亚铁和碳酸氢铵反应生成碳酸亚铁沉淀、硫酸铵、二氧化碳和水,反应的化学方程式为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑,反应温度一般需控制在35℃以下,是为了避免温度过高碳酸氢铵分解,减少铁离子的水解程度,
故答案为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑;避免温度过高碳酸氢铵分解,减少铁离子的水解程度;
(5)室温下测得溶液的pH为8.5,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8.5}}$=1×10-5.5,由题中数据可知,溶液中c(Fe2+)•c(OH-)2=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=8×10-16,故无Fe(OH)2沉淀生成,
故答案为:没有;向容器中补充适量的空气;
(6)富含的TiO2+溶液,加入Na2CO3粉末与H+反应,降低了溶液中c(H+),使平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+向生成TiO2•n H2O的方向移动,可得到TiO2粗产品,
故答案为:溶液中存在水解平衡TiO2++(n+1)H2O?TiO2•n H2O+2H+,加入的Na2CO3粉末与H+反应,降低了溶液中c(H+),促进水解平衡向生成TiO2•n H2O的方向移动;
点评 本题考查物质的制备、为高考常见题型,侧重于学生的分析能力、实验能力的考查,注意把握实验的原理和目的,为解答该类题目的关键,注意物质的性质,结合题给信息解答,难度中等.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
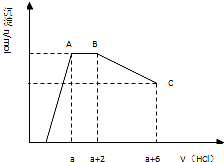 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )| A. | 溶液中一定不存在的离子:Fe3+,Mg2+,Al3+ | |
| B. | AB段可得到能使澄清的石灰水变浑浊的气体 | |
| C. | c(CO32-):c(AlO2-)=2:3 | |
| D. | BC段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.2mol | C. | 0.4mol | D. | 0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4:1 | B. | 3:1:2 | C. | 7:2:1 | D. | 9:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中通入CO2至溶液为中性,则$\frac{c({{N}_{a}}^{+})}{2c(C{{O}_{3}}^{2-})}$>1 | |
| B. | pH相同的氨水和Ba(OH)2溶液中2c(NH4+)=c(Ba2+) | |
| C. | 将CH3COONa溶液从25℃升温至40℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| D. | 向Mg(OH)2浊液中加入少量NH4Cl粉末,$\frac{c(M{g}^{2+})}{c(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 通入少量SO2,溶液漂白性增强 | |
| C. | 加入少量的碳酸钠粉末,pH增大,溶液漂白性增强 | |
| D. | 光照过程中,有气泡冒出,溶液的导电性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的电子排布式3s23p5 | B. | Cl-的结构示意图  | ||
| C. | 氯离子的电子式Cl- | D. | 质量数为37的氯原子${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证AgI的溶解度小于AgCl | 将NaI浓溶液加入AgCl悬浊液中,振荡,可观察到沉淀由白色变为黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com