
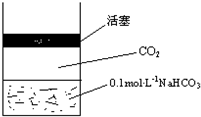
 在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )
在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )| A. | 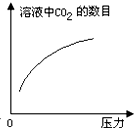 | B. | 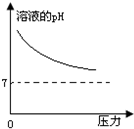 | C. |  | D. | 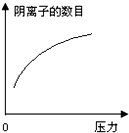 |
分析 上图的溶液中,存在HCO3-的电离平衡、水解平衡,溶液中还存在碳酸,碳酸是弱酸,碳酸溶液中存在二氧化碳的溶解平衡和电离平衡,CO2+H2O?H2CO3,H2CO3?H++HCO3-,HCO3-?H++CO32-,压力增大,导致活塞下移,二氧化碳在水中的溶解度增大,c(H2CO3)增大,碳酸的电离平衡正向移动,溶液酸性增强,pH降低,阴阳离子数目都增大,据此分析.
解答 解:A、碳酸溶液中存在二氧化碳的溶解平衡,压力增大,导致活塞下移,二氧化碳在水中的溶解度增大,所以随压力增大二氧化碳分子在水中溶解数目增多,故A正确;
B、碳酸溶液中存在电离平衡,压力增大,导致活塞下移,碳酸的电离平衡正向移动,溶液酸性增强,pH降低,会小于7,故B错误;
C、水解平衡常数只受温度影响,温度不变水解平衡常数不变,故C正确;
D、碳酸溶液中存在电离平衡,压力增大,导致活塞下移,碳酸的电离平衡正向移动,溶液中阴阳离子数目都增大,故D正确;
故选B.
点评 本题考查了气体的溶解平衡以及弱电解质的电离平衡,注意图象分析,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
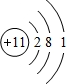 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
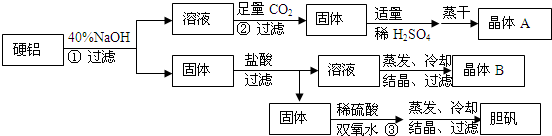
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
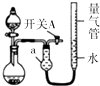 某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、浓HNO3 | H2O | |
| ② | CaO固体、浓氨水 | NH3 | |
| ③ | 粗镁、稀H2SO4 (足量)[杂质不与硫酸反应] | H2 | H2O |
| 编号 | 镁(含杂质)质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 0.5g | 10.0mL | 346.5mL |
| 2 | 0.5g | 10.0mL | 335.0mL |
| 3 | 0.5g | 10.0mL | 345.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  CCl4萃取I2后从下口放出水层 | B. | 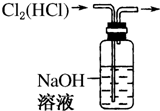 除去Cl2中的HCl | ||
| C. | 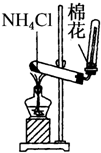 实验室制氨气 | D. | 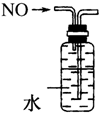 排水法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO中含有NO2,用水洗涤后再干燥 | |
| B. | CO2中含有SO2,通入饱和NaHCO3溶液后干燥 | |
| C. | NH3中含有H2O,用CaCl2进行干燥 | |
| D. | SO2中含有HCl,通入饱和NaHSO3溶液后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
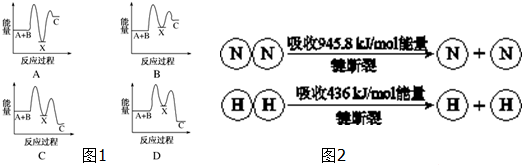
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
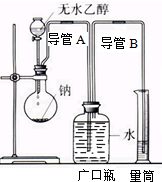 为了确定乙醇分子的结构简式CH3-O-CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,试回答下列问题:
为了确定乙醇分子的结构简式CH3-O-CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com