
分析 (1)过氧化钠可用作潜水艇里的供氧剂,与二氧化碳或水反应生成氧气;
(2)反应中Na2O2中部分O原子得电子化合价降低,部分O原子失电子化合价升高,2molNa2O2反应转移2mol电子;
(3)过氧化钠中O元素化合价为-1价,在2Na2O2+2H2O═4NaOH+O2↑的反应中,只有O元素的化合价发生变化,则Na2O2既是氧化剂又是还原剂;
(4)根据电子守恒计算出生成氧气的物质的量,然后根据V=nVm计算出生成的氧气在标准状况下的体积.
解答 解:(1)过氧化钠可用作潜水艇里的供氧剂,与二氧化碳反应生成氧气,发生反应的方程式为:2Na2O2+2CO2═2Na2CO3+O2↑,
故答案为:2Na2O2+2CO2═2Na2CO3+O2↑;
(2)反应中Na2O2中部分O原子得电子化合价降低,部分O原子失电子化合价升高,2molNa2O2反应转移2mol电子,则标出电子转移数目与方向为: ,
,
故答案为: ;
;
(3)Na2O2中O元素化合价为-1价,在反应2Na2O2+2H2O═4NaOH+O2↑中,只有O元素的化合价发生变化,所以Na2O2既是氧化剂又是还原剂,
故答案为:Na2O2; Na2O2;
(4)12.04×1023个电子的物质的量为:$\frac{12.04×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,生成1mol O2转移2mol电子,则转移2mol电子生成O2的物质的量为1mol,标准状况下1molO2的体积为:22.4L/mol×1mol=22.4L,
故答案为:22.4.
点评 本题考查了氧化还原反应的计算,题目难度中等,明确氧化还原反应的特征与实质为解答关键,注意掌握电子守恒在氧化还原反应计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 固体中一定不含有CuSO4、FeCl3 | |
| B. | 固体中一定不含有Na2CO3、一定含有Na2SO4 | |
| C. | 固体中一定含有FeCl2,不一定含有NaCl | |
| D. | 要检验固体中有没有MgCl2,需再取一份溶液,滴加NaOH溶液,若产生白色沉淀,则含有MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| B. | 纯液态水中,一定存在Kw=[H+][OH-] | |
| C. | 纯液态水中,一定存在[H+][OH-]=1×10-14mol2•L-2 | |
| D. | 25℃,[H+]=1×10-7mol•L-1的液体一定是纯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分离碘和酒精 | B. | 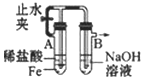 较长时间观察Fe(OH)2白色沉淀 | ||
| C. | 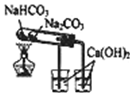 验证NaHCO3和Na2CO3的热稳定性 | D. | 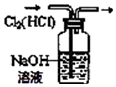 除去Cl2中HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含碳质量分数最大的有机物 | |
| B. | 最简单的有机物 | |
| C. | 是天然气的主要成分 | |
| D. | 与氯气在光照条件下能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com