
| A�� | ��Ksp��AgCl��=1.77��10-10��Ksp��Ag2CrO4��=2.0��10-12������֪AgCl�ܽ�ȱ�Ag2CrO4���ܽ�ȴ� | |
| B�� | 0.1mol/L��ZnCl2��Һ��ͨ�������������յò���ZnS��������Ϊc��Zn2+��•c��S2-����Ksp��ZnS�� | |
| C�� | ��̼�ᱵ�����м���ϡ���ᣬ��������ת��������֪���ᱵ��Ksp��̼�ᱵ�Ĵ� | |
| D�� | AgCl��10 mL 0.1 mol/L��KCl���ܽ����������10 mL 0.05 mol/L��AgNO3��Һ���� |
���� A�������ܶȻ������㱥����Һ��AgCl��Ag2CrO4���ʵ���Ũ�ȣ�
B��ZnS����ǿ����Һ��
C��̼�ᱵ���ܶȻ�Ksp=[Ba2+][CO32-]�����ᱵ���ܶȻ�Ksp=[Ba2+][SO42-]����Һ�б�����Ũ��һ��ʱ��̼�����Ũ��Զ�����������Ũ�ȣ�����ת��Ϊ̼�ᱵ��
D����Ksp��AgCl��=a������Ksp��AgCl��=c��Ag+��c��Cl-������KCl��Һ��c��Ag+����AgNO3��Һ��c��Cl-��������n=cV����n��AgCl����
��� �⣺A�������Ȼ�����Һc��AgCl��=xmol/L����x•x=1.77��10-10����ã�x��1.33��10-5�������Һ��c��Ag2CrO4��=ymol/L����2y��2��y=1.12��10-12�����y=$\root{3}{0.28}$��10-4=6.54��10-5����Ag2CrO4���ܽ�ȴ�A����
B��ZnS����ǿ����Һ�������ϸ��ֽⷴӦ��������������B����
C��̼�ᱵ���ܶȻ�Ksp=[Ba2+][CO32-]�����ᱵ���ܶȻ�Ksp=[Ba2+][SO42-]����Һ�б�����Ũ��һ��ʱ����ʹ̼�ᱵ��Ksp�����ᱵ�Ĵ�̼�����Ũ��Զ�����������Ũ�ȣ�����ת��Ϊ���ᱵ����C����
D����Ksp��AgCl��=a����0.05mol•L-1��KCl��Һ��c��Ag+��=$\frac{a}{0.05}$mol/L=20amol/L����10mL��Һ���Է�Ӧ�Ȼ���n��AgCl��=0.01L��20amol/L=0.2amol��0.01mol•L-1��AgNO3��Һ��c��Cl-��=$\frac{a}{0.01}$mol/L=100amol/L����20mL��������Һ�����ܽ��Ȼ���n��AgCl��=0.02L��100amol/L=2amol����D��ȷ��
��ѡD��
���� ���⿼���ܶȻ����йؼ��㡢����ת����֪ʶ����Ŀ�Ѷ��еȣ�ע��A�л�ѧʽ���Ƶ����ʣ��ܶȻ�ԽС���ܽ��ԽС�����ʻ�ѧʽ������Ͳ�ͬ�������ܶȻ����������жϣ�


 �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д� �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2����������������Ӧ | |
| B�� | ȼ�ϵ�������ε�� | |
| C�� | ȼ�ϵ�ص�����ת���ʳ���100% | |
| D�� | ����ʱ��������Ⱦ��ˮ�����ڻ����Ѻõ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
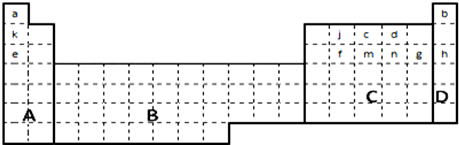
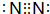 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ǻ��ĵ���ʽ��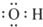 | B�� | ȩ���Ľṹ��ʽ��-COH | ||
| C�� | �۱�ϩ�Ľṹ��ʽ��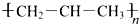 | D�� | 1-��ϩ�ļ���ʽ��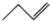 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ����������뷴Ӧ�������֮���Ϊ��Ӧ�ʱ� | |
| B�� | ��Ӧ���������С�ڷ�Ӧ������ʣ��÷�ӦΪ���ȷ�Ӧ | |
| C�� | ͬһ��Ӧ�ڲ�ͬ�¶��½��У����ʱ��Dz�ͬ�� | |
| D�� | ��֪2NO2��g���TN2O4��g����H1��N2O4��g���T2NO2��g����H2�����H1=-��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ca��OH��2��Һ�м��������NaHCO3��Һ��Ca2++2OH-+2HCO3-�TCaCO3��+CO32-+2H2O | |
| B�� | ������������������������Һ��Ӧ��pHǡ��Ϊ7��H++SO42-+Ba2++OH-�TBaSO4��+H2O | |
| C�� | NaHCO3��Һ��ϡH2SO4��Ӧ��CO32-+2H+�TCO2��+2H2O | |
| D�� | ����ϡ���ᷴӦ��2Fe+6H+�T2Fe3++3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ǽ�̫����ת��Ϊ���ܵij��ò��� | |
| B�� | �ü��ȵķ���ɱ��H7N9�����в����Dz����˵����ʱ���ԭ�� | |
| C�� | ����¡�Ĺؼ�����֮һ���ҵ�һЩ������ͨϸ����ø�������������ھƾ��б��� | |
| D�� | �ƼغϽ��ڳ����³�Һ̬�������ڿ����ӷ�Ӧ�����Ƚ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 44.8 L����������ֽ��22.4 L��������22.4 L�ķ�������546.6 kJ���� | |
| B�� | 1 mol������1 mol������Ӧ����2 molҺ̬������ų�����������546.6 kJ | |
| C�� | ��ͬ�����£�1 mol������1 mol�����������ܺ���2 mol��������������� | |
| D�� | 2 mol H-F���ļ��ܱ�1 mol H-H����1 mol F-F ���ļ���֮�ʹ�546.6 kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com