
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
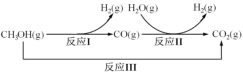
(1)已知一定条件下
反应I:CH3OH(g)=CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
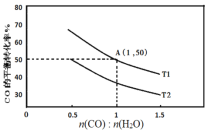
①比较T1、T2的大小,T1___T2(填“>”“<”或“=”)。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)___v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)CO2在生产中有着广泛的用途。
①将过量CO2通入KOH溶液中可生成KHCO3,请写出该反应的离子方程式___。
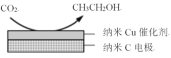
②在经CO2饱和处理的KHCO3弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。该电极为___(填“阴极”或“阳极”),电极反应式是___。
【答案】H2O(g)+CO(g)=H2(g)+CO2(g) ΔH=-41.2kJ·mol-1 < 1 < 进气比越大,反应温度越低 CO2+OH-=HCO![]() 阴极 2CO2+12e-+12H+=CH3CH2OH+3H2O
阴极 2CO2+12e-+12H+=CH3CH2OH+3H2O
【解析】
(1)由题目所给反应过程图和盖斯定律计算可得;
(2)①该反应为放热反应,升高温度平衡向逆反应方向移动;
②由题意建立三段式求解可得;
③由表格数据计算浓度熵Qc,比较浓度熵和平衡常数K的大小判断;
④由图可知,当CO平衡转化率相等时,进气比越大,反应温度越低;
(3)①过量CO2与KOH溶液反应生成KHCO3;
②由示意图可知,纳米C电极为电解池的阴极,弱酸性条件下,二氧化碳在阴极得到电子发生还原反应生成乙醇。
(1)由题目所给反应过程图可知,反应II为H2O(g)+CO(g)=H2(g)+CO2(g),根据盖斯定律可知,反应III-反应I得反应II,则该反应的ΔH=(+49.5kJ/mol)—(+90.7kJ/mol
)=-41.2 kJ/mol,热化学方程式为H2O(g)+CO(g)=H2(g)+CO2(g) ΔH=-41.2 kJ/mol,故答案为:H2O(g)+CO(g)=H2(g)+CO2(g) ΔH=-41.2 kJ/mol;
(2)①该反应为放热反应,升高温度平衡向逆反应方向移动,由图可知,进气比相同时,温度由T1变为T2时,CO转化率减小,说明平衡向逆反应方向移动,则T1<T2,故答案为:<;
②由图可知,A点CO转化率为50%,根据题目所给信息可得下列三段式:
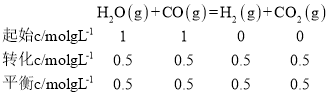
则反应平衡常数K=![]() ,故答案为:1;
,故答案为:1;
③由表格数据可知,t时刻时反应的浓度熵![]() >K=1,说明平衡向逆反应方向移动,则v(正)<v(逆),故答案为:<;
>K=1,说明平衡向逆反应方向移动,则v(正)<v(逆),故答案为:<;
④由图可知,当CO平衡转化率相等时,进气比越大,反应温度越低,故答案为:进气比越大,反应温度越低;
(3)①过量CO2与KOH溶液反应生成KHCO3,反应的离子方程式为CO2+OH-=HCO3—,故答案为:CO2+OH-=HCO3—;
②由示意图可知,纳米C电极为电解池的阴极,弱酸性条件下,二氧化碳在阴极得到电子发生还原反应生成乙醇,电极反应式为2CO2+12e-+12H+=CH3CH2OH+3H2O,故答案为:阴极;2CO2+12e-+12H+=CH3CH2OH+3H2O。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
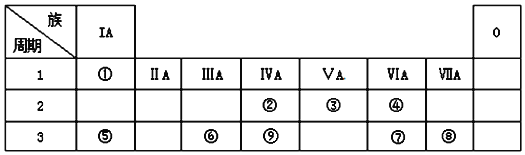
(1)第三周期中元素非金属性最强的元素的原子结构示意图为____________。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)___________。
(3)用电子式表示④的简单氢化物的形成过程______________。
(4)下列可以判断⑤和⑥金属性强弱的是_________
a.⑤单质的熔点比⑥单质低
b.⑤的化合价比⑥低
c.⑤单质与水反应比单质⑥剧烈
d.⑤最高价氧化物的水化物的碱性比⑥强
(5)由表中①、③、④、⑥、⑧元素形成的常见物质Z、M、N可发生以下反应:
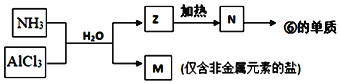
a.M中所含的化学键种类为(若含共价键,请标明极性或非极性)___________。
b.N→⑥的单质的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置进行化学反应X+2Y![]() 2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是
2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升。关于该反应的下列叙述中正确的是

①该反应为放热反应;②该反应为吸热反应;③生成物的总能量比反应物的总能量更高;④反应物的总能量比生成物的总能量更高;⑤该反应过程可以看成是“贮存“于X、Y内部的部分能量转化为热能而释放出来。
A. ①④⑤ B. ①④ C. ①③ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的位置如右图所示, B、C两元素的原子序数之和是A元素原子序数的4倍,各元素对应的物质相互比较,其中关系正确的是

A.原子半径:C>D>AB.单质的熔点:B>C,D>A
C.最高正价:B>D=A>CD.气态氢化物的稳定性:B>C,D>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
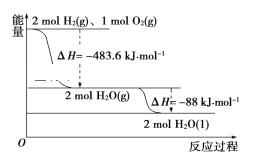
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.阅读下列材料后,回答相应问题:一个体重50kg的健康人的体内含铁2g。这2g铁在人体内不是以单质的形式存在的,而是以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于铁的吸收。
⑴人体中经常进行![]() 的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
⑵“服用维生素C,可使食物中的Fe3+转化为Fe2+”,这句话指出维生素C在这一反应中做________剂,具有________性。
Ⅱ.某化工厂排出的废液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用CO32-、OH-、Cl-三种不同的阴离子分别将上述金属阳离子逐一形成沉淀除去。加入阴离子的正确顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图所示的装置做有关CO2气体的实验:

⑴甲同学将收集满CO2气体的试管倒插入紫色石蕊试液中(左图),并轻轻振荡试管。
①描述产生的现象:____________________________________________。
②写出反应的化学方程式:____________________________________________。
⑵乙同学挤压图装置中滴管的胶头,使其中的NaOH溶液滴入烧瓶,并轻轻振荡,系在导气管一端的气球慢慢胀大。产生这一现象的原因是________________________(请用离子方程式结合必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
(1)将褐色硬块处理成粉末状。研究小组首先排除了含有单质Al杂质的可能性,实验方法是__,证明不含单质铝的现象是__。
(2)该褐色硬块的组成基本确定为Fe、Fe2O3,Al2O3。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3 mol·L-1NaOH、3mol·L-1HCl、3mol·L-1HNO3、3mol·L-1CuSO4、0.01mol·L-1KMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示。下列判断中,正确的是( )
密闭容器体积/L | 甲 | 乙 | 丙 | 丁 | |
2 | 2 | 2 | 1 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
A.甲中反应的平衡常数小于乙
B.该温度下,甲和乙中反应的平衡常数K均为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙>甲=丁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com