
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:
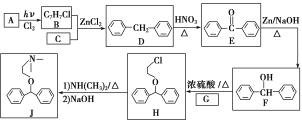
已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是___________,H中的官能团名称是_________________。
(2)由D生成E的反应类型是________,G的结构简式为_______________。
(3)B+C―→D的化学方程式为_____________________________________。
(4)L是F的同分异构体,含有联苯(![]() )结构,遇FeCl3溶液显紫色,则L有_______种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为___________________。
)结构,遇FeCl3溶液显紫色,则L有_______种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为___________________。
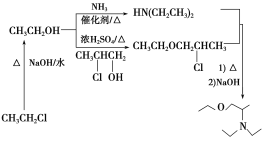
(5)写出用氯乙烷和2氯1丙醇为原料制备化合物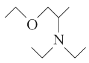 的合成路线(其他无机试剂任选)。________________
的合成路线(其他无机试剂任选)。________________
【答案】甲苯 醚键、氯原子 氧化反应 CH2OHCH2Cl 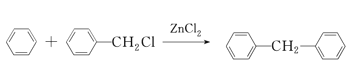 +HCl 19
+HCl 19 ![]()
【解析】
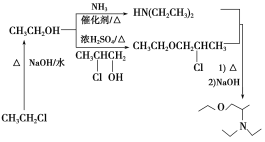
①C为最简单的芳香烃,且A、C互为同系物。C为苯,A为甲苯,A和氯气发生取代生成B(![]() ),B与C反应生成D,D氧化反应生成E,E还原生成F,F和CH2OHCH2Cl反应生成H。氯乙烷先水解生成乙醇,根据信息乙醇和氨气反应生成NH(CH2CH3)2,乙醇和浓硫酸和2氯1丙醇反应的产物再和NH(CH2CH3)2反应得到
),B与C反应生成D,D氧化反应生成E,E还原生成F,F和CH2OHCH2Cl反应生成H。氯乙烷先水解生成乙醇,根据信息乙醇和氨气反应生成NH(CH2CH3)2,乙醇和浓硫酸和2氯1丙醇反应的产物再和NH(CH2CH3)2反应得到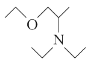 。
。
(1)根据信息得到A的化学名称是甲苯,H中的官能团名称是醚键、氯原子;故答案为:甲苯;醚键、氯原子。
(2)有机反应中,加氧去氢的反应视为氧化反应,因此D生成E的反应类型是氧化反应,根据H和F的结构简式推出G的结构简式为CH2OHCH2Cl;故答案为:氧化反应;CH2OHCH2Cl。
(3)B+C→D的化学方程式为 +HCl;故答案为:
+HCl;故答案为: +HCl。
+HCl。
(4)L是F的同分异构体,含有联苯(![]() )结构,遇FeCl3溶液显紫色含有酚羟基,还含有一个甲基,
)结构,遇FeCl3溶液显紫色含有酚羟基,还含有一个甲基,![]() ,当酚羟基在1号位,甲基有5种位置即5种结构,酚羟基在2号位,则甲基有7种位置即7种结构,酚羟基在3号位,则甲基有7种位置即7种结构,因此共有19种。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为
,当酚羟基在1号位,甲基有5种位置即5种结构,酚羟基在2号位,则甲基有7种位置即7种结构,酚羟基在3号位,则甲基有7种位置即7种结构,因此共有19种。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为![]() ;故答案为:19;
;故答案为:19;![]() 。
。
(5)氯乙烷先水解生成乙醇,根据信息乙醇和氨气反应生成NH(CH2CH3)2,乙醇和浓硫酸和2氯1丙醇反应的产物再和NH(CH2CH3)2反应得到 ,因此合成路线为:
,因此合成路线为:
 ;故答案为:
;故答案为: 。
。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如图:
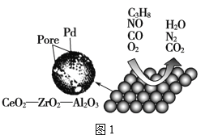
(1)Zr原子序数为40,价电子排布式为___。图1中属于非极性的气体分子是___。
(2)①氟化硼(BF3)是石油化工的重要催化剂。BF3中B-F比BF![]() 中B—F的键长短,原因是___。
中B—F的键长短,原因是___。
②乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。
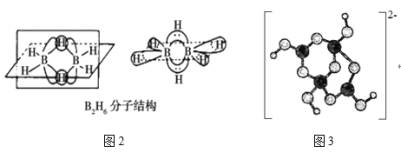
B2H6的分子结构如图2所示,其中B原子的杂化方式为___。
③H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是__。
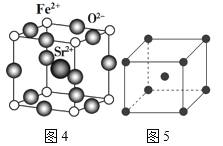
④硼酸盐是重要的防火材料。图3是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有__。
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
(3)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,[Ni(CO)4]的配体中配位原子是___。
(4)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图4所示,则与每个Sr2+紧邻的O2-有___个。
(5)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格(如图5所示),原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为___g·cm-3(用来a、b、NA表示计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是
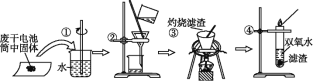
A. 操作①中玻璃棒的作用是转移固体 B. 操作②为过滤,得到的滤液显碱性
C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
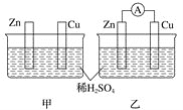
(1)以下叙述中,正确的是_______________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中![]() 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为___________;乙为______。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极:____,总反应:___。当电路中转移0.25 mol电子时,消耗负极材料的质量为_____g(Zn的相对原子质量65)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是( )
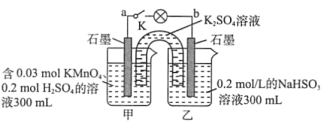
A.电池工作时,甲烧杯发生的反应为MnO4-被还原生成MnO2
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+
D.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3氧化法”制备KIO3工艺流程如图所示:

已知:酸化反应产物有KH(IO3)2、Cl2和KCl
(1)“酸化反应”所需I2从海带中提取。经历灼烧海带,浸泡海带灰等步骤,向获得的I-溶液加入MnO2,在酸性条件下生成I2,其离子反应方程式为___。
(2)酸化产物KH(IO3)2所含化学键有___,“调pH”中发生反应的化学方程式为___。
(3)已知KIO3在水中随温度升高而增大,则浓缩结晶的具体步骤是___。
(4)KIO3也可采用“电解法”制备,装置如图所示。

①KOH与I2制备KIO3的离子反应方程式为___。
②电解时阳极的电极反应式:___;阴极的电极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g) ![]() 2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是

A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Fe、Fe2O3、CuO的混合物放入体积为l00mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体 896mL(标况),得到不溶固体1.28 g,过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为 100mL)。向滤液中滴加 2mol·L-1的 NaOH溶液至40mL时开始出现沉淀。则未滴加 NaOH溶液前,滤液中 FeSO4的物质的量浓度为
A.2 mol·L-1B.l.8 mol·L-1C.1.9 mol·L-1D.无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com