
下列有关钢铁腐蚀和防护的说法不正确的是
A.自行车的钢圈上镀一层铬,防止生锈
B.外加直流电源保护钢闸门时,钢闸门与电源的负极相连
C.钢铁发生吸氧腐蚀的正极反应:2H2O +O2+4e-=== 4OH-
D.钢铁发生析氢腐蚀的负极反应:Fe – 3e-=== Fe3+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
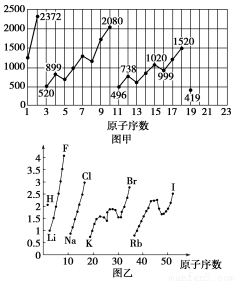
A.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系
B.图甲可能表示的是元素单质的熔点随原子序数的变化关系
C.图乙可能表示的是元素原子的半径随原子序数的变化关系
D.图乙不可能表示同族元素的电负性随原子序数的变化关系
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:填空题
(14分)下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填具体元素符号,下同),原子结构示意图为________。元素⑩名称为________在周期表中的位置________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是________,碱性最强的化合物的电子式是:________。
(3)用电子式表示元素④与⑥的化合物的形成过程:________________,该化合物属于________(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________,该化合物是由________(填“极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______________。
(6)元素③的氢化物的结构式为______;该氢化物常温下和元素⑦的单质反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
原子核外电子是有规律地进行排布的,它们分层排布在K、L、M、N、O……层上,下列叙述正确的是
A.K层上容纳的电子数只能是2个
B.K层上容纳的电子数可以超过2个
C.L层上最多只能容纳8个电子
D.最外层上容纳的电子数可以超过8个
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:选择题
某温度下,将6 mol CO2和8 mol H2 充入2 L密闭容器中发生反应CO2(g) +3H2(g)  CH3OH(g) + H2O(g) ΔH < 0,容器中H2 的物质的量随时间的变化关系如图中的实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系。下列说法正确的是
CH3OH(g) + H2O(g) ΔH < 0,容器中H2 的物质的量随时间的变化关系如图中的实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系。下列说法正确的是
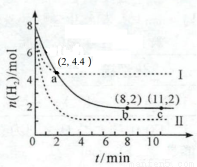
A.曲线Ⅰ对应的条件改变可能降低温度
B.曲线Ⅱ对应的条件改变可能是充入氦气
C.该温度下,此反应的化学平衡常数的数值为0.5
D.从反应开始至a 点,ν(CO2) = 0.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东湛江高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)乙酰水杨酸是一种使用广泛的解热镇痛剂。合成原理是:
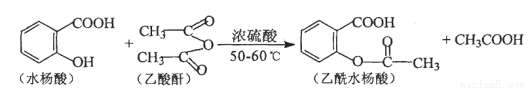
(1)乙酰水杨酸的分子式为 ,1 mol乙酰水杨酸最多能与 mol H2 反应。
(2)上面反应的反应类型是 。
(3)有关水杨酸的说法,不正确的是 。
A.能与溴水发生取代反应和加成反应
B.可发生酯化反应和水解反应
C.1 mol水杨酸最多能与2 mol NaOH反应
D.遇FeCl3溶液显紫色
(4)乙酰水杨酸与足量KOH溶液反应的化学方程式为 。
(5)乙酰氯(CH3COCl )也可以与水杨酸反应生成乙酰水杨酸,请写出化学反应方程式(不写条件) 。
(6)写出一种符合下列条件的乙酰水杨酸的同分异构体的结构简式: 。
Ⅰ.能遇FeCl3溶液显色
Ⅱ.苯环上只有2种一溴取代物
Ⅲ.1 mol该化合物能分别与含4 mol Br2的溴水或4 mol H2 反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东湛江高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列各组离子在溶液中能大量共存的是
A.K+、OH—、Na+、NO3— B.Al3+、AlO2—、HCO3—、Na+
C.Na+、Fe3+、SO42—、I— D.Fe3+、SCN—、Na+、CO32—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三二模理综化学试卷(解析版) 题型:简答题
(13分)氯气是重要的化工原料,有广泛的用途。
(1)氯气的电子式是______。
(2)电解饱和食盐水制氯气的离子方程式是______。
(3)工业上用H2和Cl2反应制HCl,反应的能量变化如图所示:

①该反应的热化学方程式是______。
②实验室配制FeCl3溶液时,将FeCl3固体溶解在稀盐酸中,请结合离子方程式用平衡移动原理解释原因______。
(4)新制饱和氯水中存在:Cl2+H2O HCl+HClO,为使平衡向正反应方向移动,下列措施可行的是______。
HCl+HClO,为使平衡向正反应方向移动,下列措施可行的是______。
a.加少量NaOH固体 b.加CaCO3固体 c.加NaCl固体
(5)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3=NH2Cl+HCl。NH2Cl能与水反应生成可以杀菌消毒的物质,该反应中元素的化合价不变。
①NH2Cl与水反应的化学方程式是______。
②在Cl2+NH3=NH2Cl+HCl中,每消耗11.2 L Cl2(标准状况下),转移电子______mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第二次模拟理综化学试卷(解析版) 题型:选择题
生活中处处有化学。下列叙述正确的是
A.装修常用的人造板材容易引起居室甲醛污染
B.用于制作集成电路板的酚醛树脂是天然高分子化合物
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.为提高农作物的产量和质量,应大量使用化肥和农药
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com