
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
在一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若先通入另一种气体,再通入SO2,则可生成白色沉淀。另一种气体不可能是( )。
A.NO2 B.Cl2 C.HCl D.NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,根据表中10种元素,用元素符号或化学式填空。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑨ | ⑧ | ⑩ |
(1)①~⑩元素中,金属性最强的是 ;化学性质最不活泼的是 。
(2)①~⑩元素中,最高价氧化物水化物呈两性的是 ,该化合物与NaOH溶液反应的离子方程式为 ;
(3)①~⑩元素中,最高价氧化物水化物酸性最强的是 ,碱性最强的是 ;
(4)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某酯的化学式是Cn+3H2n+4O2,它是化学式为CnH2n-2O2的A与有机物B反应生成物,B的化学式是
A.C3H6O B.C3H6O2 C.C3H8O D.C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室里用乙醇跟浓H2SO4反应制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2,CO2,水蒸气和炭黑。
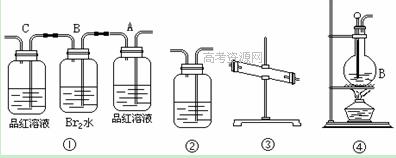
(1)用编号为①→④ 的实验装置设计一个实验,以验证上述反应混合气体中含CO2,SO2和水蒸气。用装置的连接顺序(按产物气流从左到右的流向):
→ → → →。
(2)实验的装置①中A瓶的现象是________;结论为________ 。
B瓶中的现象是________;B瓶溶液作用为________;
是否能将B瓶溶液换成酸性高锰酸钾 (答是,否)。
(3)装置③中加的固体药品是________装置②中盛的溶液是________。
(4)装置④生成乙烯的反应类型是 ;若要验证混合气体中有乙烯,应将混合气体先通过盛 的洗气瓶,再通过盛 的试管中。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )

A.4>2>1>3 B.2>1>3>4
C.4>2>3>1 D.3>2>4>1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是 ( )
A.充电时作阳极,放电时作负极 B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=__________。
 (2)降低温度,该反应K值______,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(2)降低温度,该反应K值______,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
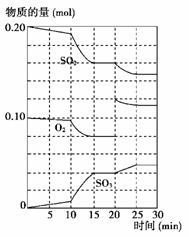
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________。
(4)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ __________________________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修2化学与技术】
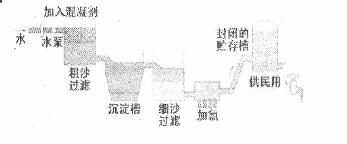 生产自来水的流程图所示。
生产自来水的流程图所示。
(1) FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)实验室过滤操作所用到的玻璃仪器是 。
(3)我们有时感觉自来水“有漂白粉的气味”,是因为使用了氯气消毒,请写出有关化学方程下列物质中, (填写序号)可以作为氯气的代用品。
①臭氧 ②NH3(溶液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱(填“阴”或 “阳”)。
(5)测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH的混合溶液,再加入KI溶液,立即塞好塞子,振荡使其完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.10mol/L Na2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:
2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O
I2+2S2O32-=2I-+S4O62-
水中的溶解氧量为 (以mg·L-l为单位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com