
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | 食品添加剂在合理限量范围内使用不影响人体健康 | |
| B. | 食品添加剂必须用天然的物质 | |
| C. | 柠檬黄常用来做着色剂,改善食品色泽 | |
| D. | 醋可用作防腐剂和调味品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数由少到多的顺序:Y、Z、X、M、N | |
| B. | 单质Y的熔点高于单质Z的熔点 | |
| C. | 元素非金属性由弱到强的顺序:M、N、X | |
| D. | 电解N和Y、Z形成的化合物可分别得到对应的Y和Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO分别与稀硫酸、稀盐酸反应 | |
| B. | CaCO3、Na2CO3分别与盐酸反应 | |
| C. | H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 | |
| D. | Na分别与水、稀盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
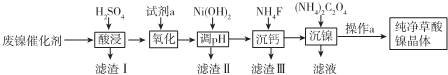
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)≥c(M+) | B. | c(A-)≤c(M+) | ||
| C. | 若MA不水解,则c(OH-)=c(A-) | D. | 若MA水解,则c( OH-)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、Al(OH)3 | B. | H2、NaAlO2 | C. | H2、NaAlO2、NaCl | D. | H2、Al(OH)3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com