
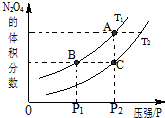
 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析 (1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,反应焓变关系可以利用盖斯定律分析得到关系,根据方程式之间的关系结合盖斯定律确定焓变关系;
(2)升高温度,平衡向吸热反应方向移动,根据移动方向和平衡常数的关系判断反应热;根据平衡常数计算反应的CO的物质的量浓度,再结合转化率公式计算一氧化碳的转化率;
(3)根据温度、压强对该反应的影响分析,化学平衡常数只与温度有关.
解答 解:(1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,平衡常数表达式为K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$,将方程式①+②得③,所以其焓变得△H1+△H2═△H3(或△H2═△H3-△H1,或△H1═△H3-△H2,
故答案为:$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;△H1+△H2═△H3或△H2═△H3-△H1,或△H1═△H3-△H2;
(2)根据表中数据知,升高温度,化学平衡常数减小,说明平衡向逆反应方向移动,则正反应是放热反应,△H2<0,根据反应方程式中各物质的关系式知,平衡时,c(CO)=0.005mol/L、c(H2)=0.015mo/L,
参加反应的c(CO)=c(H2)=0.015mo/L,一氧化碳的转化率=$\frac{0.015mol/L}{0.005mol/L+0.015mol/L}$×100%=75%,
故答案为:<;75%;
(3)该反应的正反应是放热反应,相同压强下,由C到A,四氧化二氮的体积分数增大,平衡向正反应方向移动,说明温度降低,则T1<T2;该反应的正反应是气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,温度越高,平衡常数越小,所以B>C,
故答案为:<;正反应方向;>.
点评 本题考查了外界条件对化学平衡移动的影响、盖斯定律等知识点,这些知识点都是考试热点,会根据反应方程式特点及外界条件来分析解答,难度中等.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:解答题
 为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:
为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CF4、CCl4、CBr4、CI4的熔点沸点升高与范德华力有关 | |
| B. | H2O的熔、沸点大于H2S的是由于H2O之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 分子晶体中分子一定紧密堆积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.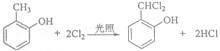 .
. .
. 既可发生酯化反应生成香豆素,可发生加聚反应.该物质加聚产物的结构简式为
既可发生酯化反应生成香豆素,可发生加聚反应.该物质加聚产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
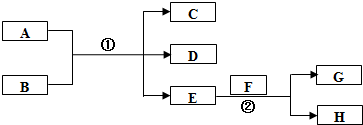
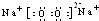 ;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.
;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{3b}{0.0224V}$ | B. | e=a+$\frac{8cV}{1000}$ | C. | d=a+$\frac{17cV}{1000}$ | D. | $\frac{82a}{65}$<e<$\frac{5a}{4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0 | |
| D. | SO2与SiO2的晶体中,化学键种类和晶体类型均相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com