
| A. | 常温常压下,1.6gCH4含有的电子数目为NA | |
| B. | 标准状况下,2.2 LCCl4含有的碳原子数目为0.1NA | |
| C. | 101kPa、0℃时,22.4LH2中氢原子数为NA个 | |
| D. | 1mol/L 的NaOH溶液中,Na+的数目为NA |
分析 A、求出甲烷的物质的量,然后根据1mol甲烷中含10mol电子来分析;
B、标况下,四氯化碳为液态;
C、101kPa、0℃时即为标况,气体摩尔体积为22.4L/mol;
D、溶液体积不明确.
解答 解:A、1.6g甲烷的物质的量为0.1mol,而1mol甲烷中含10mol电子,故0.1mol甲烷中含1mol电子即NA个,故A正确;
B、标况下,四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、101kPa、0℃时即为标况,气体摩尔体积为22.4L/mol,故故22.4L氢气的物质的量为1mol,则含2mol原子即2NA个,故C错误;
D、溶液体积不明确,故溶液中的钠离子的个数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用、物质的状态和物质的结构是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电极材料为铁和锌,电解质溶液为FeCl3溶液 | |
| B. | 电极材料为铁和铜,电解质溶液为Fe(NO3)3溶液 | |
| C. | 电极材料为铁和石墨,电解质溶液为FeCl2溶液 | |
| D. | 电极材料为石墨,电解质溶液为FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
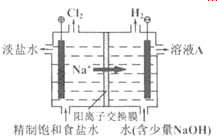 生产生活中广泛涉及氧化还原反应.
生产生活中广泛涉及氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4═Na++HSO4- | B. | NaHCO3═Na++H++CO32- | ||
| C. | KClO3═K++Cl-+3O2- | D. | Al2(SO4)3═2Al3++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,气体摩尔体积约为22.4 L/mol | |
| B. | 非标准状况下,1mol任何气体都不可能为22.4L | |
| C. | 标准状况下,22.4L任何气体的物质的量都约为1mol | |
| D. | 标准状况下,1 molH2O的体积小于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱:苛性碱、纯碱、火碱 | |
| B. | 碱性氧化物:氧化铜、氧化铁、七氧化二锰、二氧化硅 | |
| C. | 混合物:水煤气、矿泉水、盐酸 | |
| D. | 无丁达尔现象的分散系:氯化铁溶液、碘的四氯化碳溶液、蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 、I
、I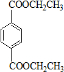 .
.
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com