
”¾ĢāÄæ”潚ŹōīŃŠŌÄÜÓÅŌ½£¬±»ÓžĪŖ¼ĢFe”¢AlŗóÓ¦ÓĆ¹ć·ŗµÄ”°µŚČż½šŹō”±”£
£Ø1£©Ti»łĢ¬Ō×ӵļŪ²ćµē×ÓÅŲ¼Ķ¼ĪŖ_______________________”£
£Ø2£©īŃÄÜÓėB”¢C”¢N”¢OµČ·Ē½šŹōŌŖĖŲŠĪ³ÉĪČ¶ØµÄ»ÆŗĻĪļ”£µēøŗŠŌ£ŗC________(Ģī”°£¾”±»ņ”°£¼”±£¬ĻĀĶ¬)B£»µŚŅ»µēĄėÄÜ£ŗN________O£¬ŌŅņŹĒ____________________________________”£
£Ø3£©ŌĀĒņŃŅŹÆ”Ŗ”ŖŠžĪäŃŅµÄÖ÷ŅŖ³É·ÖĪŖīŃĖįŃĒĢś(FeTiO3)”£FeTiO3Óė80%µÄĮņĖį·“Ó¦æÉÉś³ÉTiOSO4”£SO42-µÄæռ乹ŠĶĪŖ_________ŠĪ£¬ĘäÖŠĮņŌ×Ó²ÉÓĆ_________Ōӻƣ¬Š“³öSO42-µÄŅ»Öֵȵē×ÓĢåµÄ»ÆѧŹ½£ŗ____________________________”£
£Ø4£©TiµÄŃõ»ÆĪļŗĶCaOĻą»„×÷ÓĆÄÜŠĪ³ÉīŃĖįŃĪCaTiO3£¬CaTiO3µÄ¾§Ģå½į¹¹ČēĶ¼1ĖłŹ¾(Ti4£«Ī»ÓŚĮ¢·½ĢåµÄ¶„µć)”£øĆ¾§ĢåÖŠ£¬Ti4+ŗĶÖÜĪ§________øöO2-Ļą½ōĮŚ”£

£Ø5£©Ģś¾§°ūµÄ½į¹¹ČēĶ¼2ĖłŹ¾£¬Čē¹ū¾§°ū±ß³¤ĪŖa£¬ĢśŌ×Ó°ė¾¶ĪŖr£¬ŌņøĆ¾§ĢåÖŠĢśŌ×ÓµÄæÕ¼äĄūÓĆĀŹĪŖ________________”£
”¾“š°ø”æ 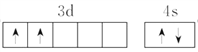 £¾ £¾ NŌ×ÓÖŠµÄ2p¹ģµĄ“¦ÓŚ°ė³äĀś×“Ģ¬£¬øüĪČ¶Ø ÕżĖÄĆęĢå sp3 ClO4-µČ 12
£¾ £¾ NŌ×ÓÖŠµÄ2p¹ģµĄ“¦ÓŚ°ė³äĀś×“Ģ¬£¬øüĪČ¶Ø ÕżĖÄĆęĢå sp3 ClO4-µČ 12 ![]()
”¾½āĪö”æ£Ø1£©TiĪŖ22ŗÅŌŖĖŲ£¬ĘäŌ×ӵĻłĢ¬µē×ÓÅŲ¼Ź½ĪŖ[Ar]3d24s2£¬ĖłŅŌĘä¼Ūµē×ÓÅŲ¼Ķ¼ĪŖ ”£
ӣ
£Ø2£©Ķ¬ÖÜĘŚŌŖĖŲ“Ó×óĻņÓŅµēøŗŠŌÖš½„Ōö“ó£¬ĖłŅŌC“óÓŚB”£NµÄ2pÄܼ¶ÖŠÓŠ3øöµē×Ó£¬Ē”ŗĆŹĒĘä°ėĀśµÄĪČ¶Ø½į¹¹£¬ĖłŅŌŹ¹NµÄµŚŅ»µēĄėÄÜ·“³£Ōö“ó£¬Ź¹µŚŅ»µēĄėÄÜN“óÓŚO”£
£Ø3£©øł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪ£¬ĮņĖįøłĄė×ÓµÄÖŠŠÄŌ×Ó£ØS£©×īĶā²ćÓŠ6øöµē×Ó£¬ÅäĪ»µÄO²»Ģį¹©µē×Ó£¬µ«ŹĒ“ųÓŠ2øöøŗµē£¬ĖłŅŌ×īĶā²ćÓŠ8øöµē×Ó£¬Ļąµ±ÓŚ4øöµē×Ó¶Ō”£æռ乹ŠĶĪŖÕżĖÄĆęĢ壬֊ŠÄŌ×ÓS×ösp3ŌӻƔ£ĘäµČµē×ÓĢ壬ӦøĆŃ”ŌńŌ×ÓŹżĻąĶ¬£¬µē×ÓŹżĻąµČµÄĄė×Ó£¬ĖłŅŌæÉŅŌŹĒClO4-”¢PO43-µČ”£
£Ø4£©Ti4+Ī»ÓŚĮ¢·½ĢåµÄ¶„µć£¬ĖłŅŌÓŠ8”Į1/8=1øö£¬øł¾Ż»ÆѧŹ½µĆµ½¾§°ūÖŠµÄCa2+Ņ²Ó¦øĆÓŠ1øö£¬ĖłŅŌĘäĪ»ÓŚ¾§°ūµÄĢåŠÄ£¬ÄĒĆ“O2-Ņ»¶ØĪ»ÓŚ¾§°ūµÄĆęŠÄ”£“ÓĶ¼1µĆµ½£¬ÓėTi4+½ōĮŚµÄO2-Ó¦øĆŹĒøĆ¾§°ūµÄĆęŠÄ”£ĪŅĆĒæÉŅŌ½«¾§°ū½ųŠŠĘ½ŅĘ£¬¼ŁÉčĘ½ŅĘŗóŠĀµÄ¾§°ūÖŠ£¬Ca2+Ī»ÓŚ¶„µć£¬Ōņ“ĖŹ±Ti4+Ī»ÓŚĢåŠÄ£¬O2-Ī»ÓŚĄāŠÄ£¬ŌņTi4+ŗĶÖÜĪ§12ĢõĄāµÄĄāŠÄÉĻµÄ12øöO2-Ļą½ōĮŚ”£
£Ø5£©ÓÉĶ¼2£¬¾§°ū±ß³¤ĪŖa£¬ŌņĢå¶Ō½ĒĻß³¤ĪŖ![]() £¬ŅņĪŖĢå¶Ō½ĒĻßÉĻµÄČżøöŌ×ÓĻąĒŠ£¬ĖłŅŌ
£¬ŅņĪŖĢå¶Ō½ĒĻßÉĻµÄČżøöŌ×ÓĻąĒŠ£¬ĖłŅŌ![]() £¬¼“
£¬¼“![]() ”£¾§°ūÖŠÓŠĮ½øöĢśŌ×Ó£Ø8”Į1/8+1”Į1=2£©£¬ĘäĢå»żĪŖ
”£¾§°ūÖŠÓŠĮ½øöĢśŌ×Ó£Ø8”Į1/8+1”Į1=2£©£¬ĘäĢå»żĪŖ![]() £¬¾§°ūĢå»żĪŖa3£¬ĖłŅŌæÕ¼äĄūÓĆĀŹĪŖ
£¬¾§°ūĢå»żĪŖa3£¬ĖłŅŌæÕ¼äĄūÓĆĀŹĪŖ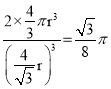 ”£
ӣ


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ż³ĢƻӊÉę¼°»Æѧ±ä»ÆµÄŹĒ( )
A.æÕĘųŅŗ»Æ
B.Ć÷·Æ¾»Ė®
C.ŗ£“ųĢįµā
D.ĆŗµÄŅŗ»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚÅØĮņĖįµÄŠšŹöÖŠ£¬ÕżČ·µÄŹĒ(””””)
A.ÅØĮņĖį¾ßÓŠĪüĖ®ŠŌ£¬Ņņ¶ųÄÜŹ¹ÕįĢĒĢæ»Æ
B.ÅØĮņĖįŌŚ³£ĪĀĻĀæÉŃøĖŁÓėĶʬ·“Ó¦·Å³ö¶žŃõ»ÆĮņĘųĢå
C.ÅØĮņĖįŹĒŅ»ÖÖøÉŌļ¼Į£¬Äܹ»øÉŌļ°±Ęų”¢ĒāĘųµČĘųĢå
D.ÅØĮņĖįŌŚ³£ĪĀĻĀÄܹ»Ź¹Ģś”¢ĀĮµČ½šŹōŠĪ³ÉŃõ»ÆĤ¶ų¶Ū»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹŹōÓŚ“æ¾»ĪļµÄŹĒ( )
A.ĘÆ°×·ŪB.ŃĪĖįC.ĀČĖ®D.Ņŗäå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŹµŃéŹŅ²śÉśµÄ·ĻŅŗÖŠŗ¬ÓŠFe3+”¢Cu2+”¢Ba2+”¢Cl©ĖÄÖÖĄė×Ó£¬ĻÖÉč¼ĘĻĀĮŠ·½°ø¶Ō·ĻŅŗ½ųŠŠ“¦Ąķ£¬ŅŌ»ŲŹÕ½šŹō²¢ÖʱøĀČ»Æ±µ”¢ĀČ»ÆĢś¾§Ģ壮 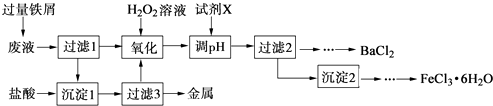
£Ø1£©³Įµķ1ÖŠŗ¬ÓŠµÄ½šŹōµ„ÖŹŹĒ £®
£Ø2£©Ńõ»ÆŹ±¼ÓČėH2O2ČÜŅŗ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ £®
£Ø3£©ĻĀĮŠĪļÖŹÖŠ£¬æÉŅŌ×÷ĪŖŹŌ¼ĮXµÄŹĒ”” ””£ØĢī×ÖÄø£©£®
A.BaCl2
B.BaCO3
C.NaOH
D.Ba£ØOH£©2
£Ø4£©¼ģŃé³Įµķ2Ļ“µÓŹĒ·ńĶźČ«µÄ·½·ØŹĒ £®
£Ø5£©ÖʱøĀČ»ÆĢś¾§Ģå¹ż³ĢÖŠŠč±£³ÖŃĪĖį¹żĮ棬ĘäÄæµÄŹĒ £®
£Ø6£©ÓɹżĀĖ2µĆµ½µÄĀĖŅŗÖʱøBaCl2µÄŹµŃé²Ł×÷ŅĄ“ĪĪŖ”¢ĄäČ“½į¾§”¢”¢Ļ“µÓ”¢øÉŌļ£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³ŃŠ¾æŠ”×éÓĆ»ĘĢśæó£ØFeS2£©”¢ĀČĖįÄĘŗĶĮņĖįČÜŅŗ»ģŗĻ·“Ó¦ÖʱøClO2ĘųĢ壬ŌŁÓĆĖ®ĪüŹÕøĆĘųĢåæɵĆClO2ČÜŅŗ£®ŌŚ“Ė¹ż³ĢÖŠŠčŅŖæŲÖĘŹŹŅĖµÄĪĀ¶Č£¬ČōĪĀ¶Č²»µ±£¬ø±·“Ó¦Ōö¼Ó£¬Ó°ĻģÉś³ÉClO2ĘųĢåµÄ“æ¶Č£¬ĒŅ»įÓ°ĻģClO2µÄĪüŹÕĀŹ£¬¾ßĢåĒéæöČēĶ¼ĖłŹ¾£® 
£Ø1£©¾ŻĶ¼æÉÖŖ£¬·“Ó¦Ź±ŠčŅŖæŲÖʵďŹŅĖĪĀ¶ČŹĒ”ę£¬ŅŖ“ļµ½“ĖŅŖĒóŠčŅŖ²ÉČ”µÄ“ėŹ©ŹĒ £®
£Ø2£©ŅŃÖŖ£ŗ»ĘĢśæóÖŠµÄĮņŌŖĖŲŌŚĖįŠŌĢõ¼žĻĀæɱ»ClO3©Ńõ»Æ³ÉSO42© £¬ ĒėŠ“³öÖʱø¶žŃõ»ÆĀČ£ØClO2£©µÄĄė×Ó·½³ĢŹ½£ŗ £®
£Ø3£©øĆŠ£»ÆѧѧĻ°Š”×éÄāŅŌ”° ![]() ”±×÷ĪŖŗāĮæClO2²śĀŹµÄÖø±ź£®ČōČ”NaClO3ѳʷ6.0g£¬Ķعż·“Ó¦ŗĶĪüŹÕ»ńµĆ400mL ClO2ČÜŅŗ£¬Č”“ĖČÜŅŗ20mLÓė37.00mL 0.500molL©1 £ØNH4£©2Fe£ØSO4£©2ČÜŅŗ³ä·Ö·“Ó¦ŗ󣬹żĮæµÄFe2+ŌŁÓĆ0.050 0molL©1K2Cr2O7±ź×¼ČÜŅŗµĪ¶ØÖĮÖÕµć£¬ĻūŗÄK2Cr2O7±ź×¼ČÜŅŗ20.00mL£®·“Ó¦ŌĄķĪŖ£ŗ 4H++ClO2+5Fe2+ØTCl©+5Fe3++2H2O
”±×÷ĪŖŗāĮæClO2²śĀŹµÄÖø±ź£®ČōČ”NaClO3ѳʷ6.0g£¬Ķعż·“Ó¦ŗĶĪüŹÕ»ńµĆ400mL ClO2ČÜŅŗ£¬Č”“ĖČÜŅŗ20mLÓė37.00mL 0.500molL©1 £ØNH4£©2Fe£ØSO4£©2ČÜŅŗ³ä·Ö·“Ó¦ŗ󣬹żĮæµÄFe2+ŌŁÓĆ0.050 0molL©1K2Cr2O7±ź×¼ČÜŅŗµĪ¶ØÖĮÖÕµć£¬ĻūŗÄK2Cr2O7±ź×¼ČÜŅŗ20.00mL£®·“Ó¦ŌĄķĪŖ£ŗ 4H++ClO2+5Fe2+ØTCl©+5Fe3++2H2O
14H++Cr2O72©+6Fe2+ØT2Cr3++6Fe3++7H2O
ŹŌ¼ĘĖćClO2µÄ”°²śĀŹ”±£ØŠ“³ö¼ĘĖć¹ż³Ģ£©£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ³äČė1mol AŗĶb mol BĘųĢ壬·¢ÉśČēĻĀ·“Ó¦£ŗA£Øg£©+B£Øg£©2C£Øg£©£¬5minŗó·“Ó¦“ļµ½Ę½ŗāŹ±n£ØA£©ĪŖ0.4mol£®ŌŚ·“Ó¦¹ż³ĢÖŠĢåĻµµÄĪĀ¶Č³ÖŠųÉżøߣ¬ŹµŃé²āµĆ»ģŗĻĘųĢåÖŠCµÄŗ¬ĮæÓėĪĀ¶ČµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾£®ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£© 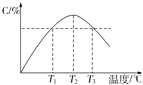
A.0”«5 min£¬CĪļÖŹµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.04 molL©1min©1
B.Ķ¼ÖŠĪĀ¶ČT1Ź±µÄÕż·“Ó¦ĖŁĀŹµČÓŚĪĀ¶ČT3Ź±µÄÕż·“Ó¦ĖŁĀŹ
C.øĆ·“Ó¦ĪĀ¶ČT2Ź±µÄĘ½ŗā³£Źż“óÓŚĪĀ¶ČT3Ź±µÄĘ½ŗā³£Źż
D.Ķ¼ÖŠT2Ź±£¬ČōÖ»Ōö“óŃ¹Ē棬ŌņÕż”¢Äę·“Ó¦ĖŁĀŹ²»øıä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°±ĘųŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤²śĘ·£¬ŹĒÉś²śļ§ŃĪ”¢ÄņĖŲµČŌĮĻ£¬¹¤ŅµŗĻ³É°±µÄ·“Ó¦ČēĻĀ£ŗ N2£Øg£©+3H2£Øg£©2NH3£Øg£©”÷H=Ņ»92.4KJmol©1
£Ø1£©ŅŃÖŖH2£Øg£©µÄČ¼ÉÕČČĪŖ285KJ/mol£¬Š“³öNH3£Øg£©ŌŚ“æŃõÖŠČ¼ÉÕÉś³ÉĪŽ¶¾”¢ĪŽŗ¦ĪļÖŹµÄČČ»Æѧ·½³ĢŹ½£®
£Ø2£©25”ꏱ£¬½«a mol £ØNH4£©2SO4ČÜÓŚĖ®£¬ĻņøĆČÜŅŗÖŠµĪ¼ÓV LĻ”°±Ė®ŗóČÜŅŗ³ŹÖŠŠŌ£¬ŌņµĪ¼Ó°±Ė®µÄ¹ż³ĢÖŠĖ®µÄµēĄėĘ½ŗā½«£ØĢī”°ÕżĻņ”±”¢”°²»”±»ņ”°ÄęĻņ”±£©ŅĘ¶Æ£¬ĖłµĪ¼ÓĻ”°±Ė®µÄĪļÖŹµÄĮæÅضČĪŖmolL©1 £® £Ø25”ꏱ£¬NH3H2OµÄµēĄėĘ½ŗā³£ŹżKb”Ö2”Į10©5£©
£Ø3£©¹¤ŅµÉĻ³£ĶعżČēĻĀ·“Ó¦ŗĻ³ÉÄņĖŲ[CO£ØNH2£©2]£ŗ CO2£Øg£©+2NH3£Øg£©CO£ØNH2£©2£Øl£©+H2O£Øg£©”÷H£¼0£¬t”ꏱ£¬ĻņČŻ»żŗć¶ØĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė0.10molCO2ŗĶ0.40molNH3 £® ·“Ó¦ÖŠCO2£Ø g£©µÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆČē±ķĖłŹ¾£ŗ
Ź±¼ä/min | ””0 | 30 | 70 | 80 | 100 |
n£ØCO2£©/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
¢Ł20minŹ±£¬¦ŌÕż£ØCO2 £©80minŹ±£®¦ŌÄę£ØH2O£©£ØĢī”°£¾”±”¢”°=”±»ņ”°£¼”±£©£®ŌŚt”ꏱ£¬øĆ·“Ó¦¶īĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK=£»
¢ŚŌŚ100minŹ±£¬±£³ÖĘäĖüĢõ¼ž²»±ä£¬ŌŁĻņČŻĘ÷ÖŠ³äČė0.050mo1CO2ŗĶ0.20molNH3 £¬ ÖŲŠĀ½ØĮ¢Ę½ŗāŗóCO2µÄ×Ŗ»ÆĀŹÓėŌĘ½ŗāĻą±Č½«£ØĢī”°Ōö“ó”±”¢”°²»±ä”±»ņ”°¼õŠ””±£©£®
¢ŪÉĻŹöæÉÄę·“Ó¦µÄĘ½ŗā³£ŹżĪŖ£Ø±£Įō¶žĪ»Š”Źż£©£®
¢Üøł¾Ż±ķÖŠŹż¾ŻŌŚĶ¼¼×ÖŠ»ęÖĘ³öŌŚt”ęĻĀNH3µÄ×Ŗ»ÆĀŹĖꏱ¼ä±ä»ÆµÄĶ¼Ļó£»±£³ÖĘäĖüĢõ¼ž²»±ä£»Ōņ£Øt+10£©”ęĻĀÕżČ·µÄĶ¼ĻóæÉÄÜŹĒ£ØĢīĶ¼¼×ÖŠµÄ”°A”±»ņ”°B”±£©£® 
¢ŻĶ¼ŅŅĖłŹ¾×°ÖĆ£ØŅõ”¢Ńō¼«¾łĪŖ¶čŠŌµē¼«£©æÉÓĆÓŚµē½āÄņĖŲ”²CO£ØNH2£©2”³µÄ¼īŠŌČÜŅŗÖĘČ”ĒāĘų£®øĆ×°ÖĆÖŠŃō¼«µÄµē¼«·“Ó¦Ź½ĪŖ £¬ ČōĮ½¼«¹²ŹÕ¼Æµ½ĘųĢå22.4L£Ø±źæö£©£¬ŌņĻūŗĵÄÄņĖŲĪŖg£ØŗöĀŌĘųĢåµÄČܽā£©£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹŅĪĀĻĀ£¬ÓĆ0.1000mol/LŃĪĖį·Ö±šµĪ¶Ø20.00mLÅØ¶Č¾łĪŖ0.1000mol/LĒāŃõ»ÆÄĘČÜŅŗŗĶ°±Ė®£¬µĪ¶Ø¹ż³ĢÖŠČÜŅŗpHĖę¼ÓČėŃĪĖįĢå»żV[HCl(aq)]µÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. ¢ń±ķŹ¾ŹĒµĪ¶Ø°±Ė®µÄĒśĻߣ¬V[HCl(aq)]=20mLŹ±:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. pH=7Ź±£¬Į½ÖÖČÜŅŗÖŠ:c(Na+)=c(NH4+)
C. µĪ¶ØĒāŃõ»ÆÄĘČÜŅŗ£¬V[HCl(aq)]>20mLŹ±æÉÄÜÓŠc(Cl-)>c(Na+)>c(H+)>c(OH-)
D. Ļū¶Ø°±Ė®Ź±£¬µ±V[HCl(aq)]=10mLŹ±£¬ÓŠ2[c(OH-)-c(H+)]=c(NH4+)-c(NH3”¤H2O)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com