
25℃和1.01×105Pa时,2N2O5(g) 4NO2(g)+O2(g) △H=+56.7 kJ/mol,其自发进行的原因是( )
4NO2(g)+O2(g) △H=+56.7 kJ/mol,其自发进行的原因是( )
A.反应是放热反应 B.反应是吸热反应
C.熵增大效应大于能量效应 D.是熵减小的反应
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源:2016-2017学年江西省高一12月月考化学卷(解析版) 题型:选择题
下列离子的检验方法合理的是 ( )
A.向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变血红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有F e3+
e3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一12月月考化学试卷(解析版) 题型:选择题
下列叙述中,正确的是
A.铝和酸、碱反应都表现出较强的还原性
B.铝箔在空气中受热熔化并迅速燃烧
C.钠燃烧后得到白色固体
D.自然界中钠以过氧化钠、氢氧化钠和氯化钠等形式存在
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南浏阳一中等两校高二12月联考化学卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应
X(g)+ Y(g) 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是 ( )
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是 ( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南浏阳一中等两校高二12月联考化学卷(解析版) 题型:选择题
下列说 法正确的是( )
法正确的是( )
A. 用润湿的pH试纸测定稀碱溶液的pH,测定值偏小
B. 用碱式滴定管量取22.00mL的KMnO4溶液
C. 在未知液中滴加 BaCl2溶液产生白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中一定含有SO42-或SO32-
BaCl2溶液产生白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中一定含有SO42-或SO32-
D. 实验室制备氢氧化铁胶体的方法是将氢氧化钠稀溶液滴入饱和氯化铁溶液中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期末化学卷(解析版) 题型:计算题
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的物质的量为________mol,NO2的物质的量为________mol。
(2)待产生的气体全部释放后,向溶液中加入VmL、amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水_______g。
(书写计算过程)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期末化学卷(解析版) 题型:选择题
下列说法错误的是( )
A. Na2SO3与BaCl2溶液作用,有白色沉淀生成,加稀HNO3后沉淀消失
B. 将SO2气体分别通入Ba(OH)2溶液、FeCl3与BaCl2的混合溶液、HNO3酸化的BaCl2溶液中,均可有白色沉淀生成
C.将SO2气体通入BaCl2溶液中没有白色沉淀生成,将SO2气体通入Ba(NO3)2溶液中有白色沉淀生成
D.将SO2气体、Cl2一起通入BaCl2溶液中,或将SO2气体、NO2气体一起通入BaCl2 溶液中,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期末化学卷(解析版) 题型:选择题
在溶液中能共存,加入OH-有沉淀 析出,加入H+能放出气体的是( )
析出,加入H+能放出气体的是( )
A.Na+、H+、NO 、Cl- B.K+、H+、Cl-、SO
、Cl- B.K+、H+、Cl-、SO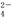
C.Ca2+、NO 、HCO
、HCO 、Cl- D.Fe3+、NH
、Cl- D.Fe3+、NH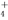 、SCN-、Cl-
、SCN-、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三模拟四化学卷(解析版) 题型:实验题
用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取二氧化锰(EMD)的工艺流程如下:
I. 将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II. 向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III. 过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV. 将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是 。完成酸浸过程中反应的离子方程式:
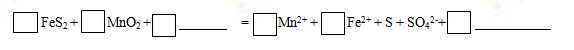
(2) 加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理: 。(结合离子方程式解释)
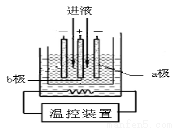
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是
极(填“a”或“b”),生成EMD的电极反应式是 。
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是 (填字母序号)。[来源
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com