
��[ʵ�黯ѧ]
���Ǽ�����ͪ�׳Ʋ��ͪ������ɫ��״���壬�۵�58�棬�е�208�棨3.3kPa���������ѡ��ȷºͱ������ڴ����Ʊ�ԭ�����£�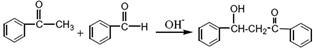
 (���ͪ)
(���ͪ)
��1���Ʊ������У����ڽ����µμӱ���ȩ�������Ƶμ��ٶ�ʹ��Ӧ�¶�ά����25��30�棬˵���÷�Ӧ�� ������Ȼ����ȣ���Ӧ�����¶ȹ���ʱ������Բ�ȡ ��ʩ��
��2����Ʒ�ᾧǰ�����Լ��뼸����Ʒ�IJ��ͪ���������� ��
��3���ᾧ��ȫ��������ռ��������װ����������������
��ѹϵͳ��� �� (����������)��
��4����õ���ɫ�ֲ�Ʒ�������̿����95%�Ҵ��ؽᾧ���������̿�������� ��
��1������ ��2�֣� ��ˮԡ��ȴ��2�֣���2���ṩ���֣����ٽᾧ��2�֣�
��3������ƿ ��2�֣� ����©����2�֣� ��4��������ɫ��2�֣�
���������������1�����Ƶμ��ٶ�ʹ��Ӧ�¶�ά����25��30�棬˵���÷�Ӧ���ȣ����Ը÷�Ӧ�Ƿ��ȷ�Ӧ������¶ȹ��ߣ��ɲ�ȡ��ˮԡ��ȴ�ķ�����
��2����Ʒ�IJ��ͪ��Ϊ���壬�������ṩ���֣����ٽᾧ�����á�
��3������װ����Ҫ����ƿ������©����
��4������̿��������н�ǿ�������ԣ����Լ������̿�������ǣ�������ɫ��
���㣺���⿼��ʵ���������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��������ʵ���������ý��۴������ 
| ʵ�� | ʵ������ | ���� |
| A | ���ձ�����Ƭ���������ݣ����ձ���ͭƬ���������� | ��ԣ�Al��Fe��Cu |
| B | �Թ����ռ�����ɫ���� | ͭ��Ũ���ᷴӦ������NO |
| C | �Թ�b���Թ�a����Һ�ĺ�ɫ�� | ����Ӧ��Ũ�ȣ�ƽ��������Ӧ�����ƶ� |
| D | ����©����Һ�������ƿ��Һ���ұ��ֲ��� | װ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ʵ���ܴﵽĿ�ĵ���
| A����п��ϡ�����Ʊ�H2 |
| B��������KMnO4��Һ����1-��ϩ�ͼױ� |
| C���ö����ЧӦ��������Һ��ʳ��ˮ |
| D����ˮ����ȥNO2��������NO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ͭ��ʯ��Ҫ��������ͭ��Cu2S����������ʯ��SiO2����һ���Ի�ͭ��ʯΪԭ���Ʊ�����ͭ�Ĺ����������£�
��д����ȡ������Cu2S�ܽ�����ӷ���ʽ��____________________��
�ƻ���S�������¶ȿ�����50��60��֮�䣬���˹�����͵�ԭ����_____________��
������NOx��������Ϻ�ͨ��ˮ�������������п�ѭ�����õ�һ�����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ___________________________������ҺM�м��루��ͨ�룩����__________������ĸ�����ʣ��õ���һ�ֿ�ѭ�����õ����ʡ�
a���� b������ c���������
�ȱ��³��������У�����CuO��Ŀ����________________________������Ũ��ʱ��Ҫ��HNO3��Һ������Һ��pH����������___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��1��ijѧϰС��������ͼװ����ȡ������̽�������ʡ�
�ټ�װ���з�Ӧ�Ļ�ѧ����ʽ�� ��
��֤����װ����FeCl2��Һ��Cl2�����˷�Ӧ��ʵ�鷽���ǣ�ֻע���Լ������� ��
�۱�װ����ͨ������Cl2�����Ƶ�ij�������г��õ�Ư�ס����������ʡ���֪̼�������ǿ�ڴ����ᣬ����з�Ӧ�Ļ�ѧ����ʽ�� ��
��2����һƿ���ڷ��õ�Ư�ۣ������������������Լ�����ɸ�Ư�۳ɷݵ�̽����
�Թܡ���ͷ�ιܡ������ܵĵ�����������ˮ��1mol��L-1���ᡢƷ����Һ�����Ƴ���ʯ��ˮ��
��������衿����һ����Ư��δ���ʣ���CaCl2��Ca��ClO��2��
���������Ư��ȫ�����ʣ��� ��
����������Ư�۲��ֱ��ʣ���CaCl2��Ca��ClO��2��CaCO3 ��
������ʵ�顿�ڴ��������±������ؼ���Ca2+��Cl-����
| ʵ�鲽�� | Ԥ������ͽ��� | |
| �� | ��A�Թ�ȡ��������ʯ��ˮ���ã���B�Թ�ȡ������Ʒ������B�Թ� | ��������ų��ҳ���ʯ��ˮδ�����ǣ������һ������ |
| �� | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��1��С���������о��¶ȶԷ�Ӧ���ʵ�Ӱ�족ʵ��ʱ����ȡ����ֻ�Թܣ�������4mL 0��01mol/L��KMnO4������Һ��2mL 0��1mol/L H2C2O4���Ҷ��ᣩ��Һ����A�Թ�������ˮ�У�B�Թ�������ˮ�У���¼��Һ��ɫ�����ʱ�䡣
����Ҫ���� ���ữKMnO4��Һ����ɫ����ʱ��tA ��tB�����������=����������
��д���÷�Ӧ�����ӷ���ʽ�� ����
��2��ʵ������ƿ������ɳ���Ҷ�����Ʒ��С�����������Ӧ��ԭ�����ⶨ�京�����������Ϊ��
������250mL��Һ��ȷ����5��0g�Ҷ�����Ʒ�����250mL��Һ��
�ڵζ���ȷ��ȡ25��00mL������Һ����ƿ�У����������ữ����0��1000mol��L��1KMnO4��Һװ��
�� �������ʽ����ʽ�����ζ��ܣ����еζ���������ʵ���з��֣��յ�������KMnO4��Һʱ����ҺѸ�ٱ���Ϻ�ɫ������ƿҡ��һ��ʱ����Ϻ�ɫ������ʧ���ټ����μ�ʱ���Ϻ�ɫ�ͺܿ���ɫ�ˡ������ԭ���� ������ ��֤���ﵽ�ζ��յ㣮
�ۼ��㣺���ظ���������2�Σ���¼ʵ���������£�
| ��� | �ζ�ǰ������mL�� | �ζ��������mL�� |
| 1 | 0��00 | 20��10 |
| 2 | 1��00 | 20��90 |
| 3 | 0��00 | 21��10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��14�֣�
ij��ѧ��ȤС��Ϊ̽��Cl2��Br2��Fe3+��������ǿ�������������ʵ�飺
��1�� �ټ�����巢��װ��A�������ԵIJ����ǣ��ߣߣߣߣߣߣߣߣߣߣߣ�
������ʵ��װ�ô���һ�����Բ��㣬��ָ���ߣߣߣߣߣߣߣߣߣߣߣߣߣ�
��2�� �ø������װ�ý���ʵ�飮ʵ��������£�
| ʵ����� | ʵ������ | ���� |
| ����a����Բ����ƿ�е�������Ũ���Ȼ��رջ���a����ȼ�ƾ��� | Dװ���У���Һ��� Eװ���У�ˮ����Һ�����CCl4�������Ա仯 | Cl2��Br2��Fe3+����������ǿ������˳��Ϊ�� ______________________ |
| ��SCN��2������±�ص������ƣ������ԣ�Cl2����SCN��2�� ��Cl2��Br2��Ӧ����BrCl�����ʺ�ɫ���Դ���ɫ�����е�Ϊ5�棬��ˮ����ˮ�ⷴӦ�� ��AgClO��AgBrO��������ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�������ƣ�NaN3����������ȫ�����е���Ҫ�ɷ֣����ڷ�����ײ��˲��ֽ�����������彫���ҹ���ʵ���Ҳⶨ����������Ʒ��NaN3������������ʵ�鲽�����£�
�ٳ�ȡԼ2.5000g�����������������250mL��Һ��
��ȷ��ȡ25.00mL��Һ������ƿ�У��õζ��ܼ���50.00mL 0.1000mol��L��1
(NH4)2Ce(NO3)6����������泥���
[������ӦΪ��2(NH4)2Ce(NO3)6 +2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2��]�����ʲ����뷴Ӧ����
�۷�Ӧ����Һ��ϡ�ͣ�Ȼ������Һ�м���5mLŨ���ᣬ����2���ڷ�����ָʾҺ����0.0500mol��L��1(NH4)2Fe(SO4)2����������泥����ζ���Һ�ζ�������Ce4+����Һ�ɵ���ɫ��Ϊ�ƺ�ɫ�������ķ�ӦΪ��Ce4++Fe2+= Ce3++Fe3+����������������隣���Һ24.00mL��
��1����������Ƶ���������Һʱ�������õ��ձ�������������Ͳ�⣬���õ��IJ��������� �� ��
��2������������ײ��ʱ�������ֵ��ʣ���Ӧ�Ļ�ѧ����ʽΪ ��
��3��������������ȷ���ζ����յ��ȡ�ζ����� (NH4)2Fe(SO4)2����Һ�����ͼͼʾ��ȡ�����������ⶨ��Ʒ�е��������������� ��ѡ���ƫ����ƫС�����䡱����
��4��ͨ������ȷ���������������к�NaN3����������Ϊ���٣�д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ʵ������Ũ������ͭ�ķ�Ӧ��ȡ����NaHSO3��ʵ��װ����ͼ��ʾ��
��1��װ���ҵ�������_____________________��
��2��װ�ö���������������Ⱦ������SO2���壬�䷴Ӧ�����ӷ���Ϊ ��
��3�� SO2 ������Ư���ԡ���ԭ�Ժ������ԡ���SO2 ͨ����ˮ�У�SO2���ֵ���________�ԣ���ѧ��Ӧ����ʽΪ ��
��4����Ӧ�����У������еι����Ʒ����Һ������ƿ��������Ϊ ������Һ�е�NaOH��ȫת��Ϊ��NaHSO3��
��5��������û�м���Ʒ����Һ������ȷ�ж����������Ƿ���ȫת�������пɹ�ѡ����������Լ����ձ����Թܡ�����������ͷ�ιܣ� 2 mol/L���ᡢ2 mol/L���ᡢ1 mol/L�Ȼ�����Һ��l mol/L����������Һ��Ʒ����Һ������ˮ��
�����ʵ��̽�����պ�������Ƿ����NaHSO3 ��Na2SO3����ʵ�������Ԥ�ڵ�ʵ������ͽ��������±��С�
| ʵ����� | Ԥ����������� |
| ����1��ȡ��������Һ�����Թ��У��μӹ���lmol/L�Ȼ�����Һ������һ��ʱ��õ���ҺA����B�� | |
| ����2��������B�м�������ˮϴ�ӳ��������ú���ȥ�ϲ���Һ����������2�Σ���������Ʒ�죬�� | ��Ʒ����ɫ���������ݣ����� |
| ����3�� | �� �� �� ���� �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com