
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3•H2O)=1×10-4mol•L-1 | |
| B. | 由CH3COOH与CH3COONa组成的pH=5.6的混合溶液中:c(Na+)<c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①<② |
分析 A、氯化铵水解生成盐酸和一水合氨,溶液中存在水的电离平衡;
B、由CH3COOH与CH3COONa组成的pH=5.6的混合溶液显酸性,说明醋酸电离程度大于醋酸根离子的水解程度,结合电荷守恒分析;
C、HF是弱酸存在电离平衡,pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合溶液显酸性;
D、酸碱抑制水的电离,水解的盐促进水的电离.
解答 解:A、氯化铵水解生成盐酸和一水合氨,溶液中存在水的电离平衡,pH=4的氯化铵溶液中,c(H+)>c(NH3•H2O),故A错误;
B、由CH3COOH与CH3COONa组成的pH=5.6的混合溶液显酸性,说明醋酸电离程度大于醋酸根离子的水解程度,结合电荷守恒分析,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),c(H+)>c(OH-),则c(Na+)<c(CH3COO-),故B正确;
C、HF是弱酸存在电离平衡,pH=2的HF溶液中氢离子浓度与pH=12的NaOH溶液中 氢氧根离子浓度相同,按照体积比1:1混合溶液显酸性,c(H+)>c(OH-),故C错误;
D、酸碱抑制水的电离,水解的盐促进水的电离,pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①<②,故D正确;
故选BD.
点评 本题考查了电解质溶液中离子浓度大小分析判断,溶液中电荷守恒的分析应用,弱电解质电离平衡和水电离平衡的影响因素分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | AgI比AgCl更难溶于水,所以AgCl易转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| D. | AgCl不溶于水,不能转化为AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、NO2均为酸性氧化物 | |
| B. | 稀豆浆、鸡蛋清溶液、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、甲苯均为电解质 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
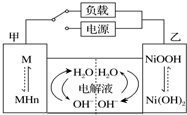 发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )| A. | 在刹车和下坡时,甲电极的电极反应式为:H2+2OH--2e-═2H2O | |
| B. | 在上坡或加速时,甲电极周围溶液的pH将减小 | |
| C. | 在上坡或加速时,溶液中的K+向甲电极迁移 | |
| D. | 在刹车和下坡时,乙电极增重 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
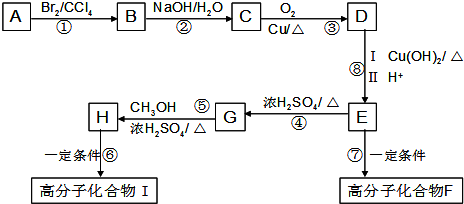
 (2)E中的官能团名称是羟基、羧基
(2)E中的官能团名称是羟基、羧基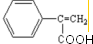 (4)反应②、④的反应类型分别是取代反应、消去反应
(4)反应②、④的反应类型分别是取代反应、消去反应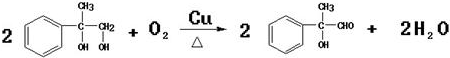 ;反应⑦n
;反应⑦n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$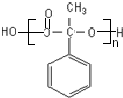 +(n-1)H2O;
+(n-1)H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将干燥纯净的氯气通入装有湿润的红色纸条的试剂瓶中 | 红色褪去 | 氯气有漂白性 |
| B | 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中 | 酸性KMnO4溶液紫红色褪去 | 证明乙烯能被酸性高锰酸钾氧化 |
| C | 取少量BaSO4固体于试管中,加入足量的盐酸 | 沉淀不溶解 | BaSO4不溶于盐酸,且可以用盐酸和BaCl2溶液检验SO42- |
| D | 在分液漏斗中加入碘水后再加入苯,充分振荡 | 分层,且上层溶液呈紫色 | 苯可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
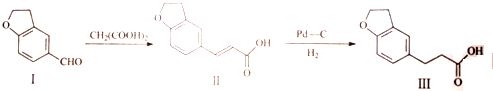
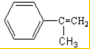
| A. | 可用浓溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 1mol化合物Ⅰ最多能与3molH2发生加成反应 | |
| D. | 与化合物Ⅰ互为同分异构体,且分子含有2个醛基的芳香族化合物有10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z<M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com