
 熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO32--4e-=4CO2分析 (1)该燃料电池中,负极上CO失电子和碳酸根离子反应生成二氧化碳,正极上氧气得电子和二氧化碳反应生成碳酸根离子;
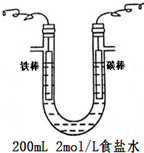
(2)电解食盐水时,阴极氢离子得电子,阳极氯离子失电子,活性电极不能作阳极;结合转移电子与反应物之间的关系计算;
(3)依据电解精炼铜原理分析,粗镍做阳极,发生氧化反应,精镍做阴极发生还原反应据此分析解答.
解答 解:该熔融盐燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2 CO32-,
故答案为:O2+2CO2+4e-═2CO32-;
(2)电解食盐水时,阴极氢离子得电子,阳极氯离子失电子,活性电极不能作阳极,所以铁棒作阴极,与负极相连;电极方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2+Cl2+2OH-;
当电池内通过0.2mol 电子时,生成0.1mol氢气,0.1mol氯气和0.2molOH-,则所得气体的总体积为0.2mol×22.4L/mol=4.48L,溶液中c(OH-)=$\frac{0.2mol}{0.2L}$=1mol/L,所以溶液的pH=14;
故答案为:负极;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2+Cl2+2OH-;4.48;14;
(3)a.电解过程中,电能转化为化学能,故A错误;
b.粗镍作阳极,金属失电子发生氧化反应,故b错误;
c.Cu、Pt、Au金属活动性比镍弱,不放电,沉降在阳极区形成阳极泥,利用阳极泥可回收Cu、Pt、Au等金属,故c正确;
d.根据阴极的电极反应式Ni2++2e-=Ni 可知每通过2mol电子,析出1mol镍,所以粗镍精炼时通过的电量与阴极析出镍的质量成正比,故d正确;
故答案为:cd.
点评 本题考查化学电源新型电池、电解原理的应用,侧重考查电极反应式的书写和电子守恒在计算中的应用,燃料电池电极反应式的书写是学习难点,燃料电池中,负极上燃料失电子、正极上氧化剂得电子,题目难度中等.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
 下列各种物质,有的具有多个官能团:请填写下列空白(填编号):
下列各种物质,有的具有多个官能团:请填写下列空白(填编号):查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJmor-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+202 (g)═C02 (g)+2H20(g)△H=-890.3kJ mol-1 | |
| B. | 500 V、30MPa下,将0.5molN2和1.5 molH2置于密闭的容器中充分反应生成 NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2 (g)$?_{500℃、30Mp}^{催化剂}$2NH3(g)△H=-38.6 kJmol-1 | |
| C. | 同温同压下,等物质的量的H2与足量的C12在光照和点燃条件下充分反应,所产生的热量相同 | |
| D. | 已知中和热为57.3 kJ/mol,则稀硫酸与氢氧化钡溶液反应的热化学方程式为 2H+(aq)+SO42-(aq)+Ba2+(aq)+20H-(aq)=BaS04 (s)+2H20(l)△H=-57.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
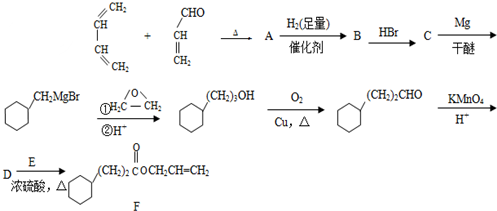

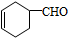 ,A中所含官能团的名称是醛基、碳碳双键;
,A中所含官能团的名称是醛基、碳碳双键;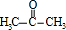 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量N2和CO2中,共用电子对的个数比为3:4 | |
| B. | 该反应中化合价变化的有N和C元素 | |
| C. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 | |
| D. | 当x=2时,每生成1mol N2,转移电子数为4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com