
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH﹣离子浓度分别为Amol•L﹣1与Bmol•L﹣1,则A和B的关系为( )
|
| A. | A>B | B. | A=10﹣4B | C. | B=10﹣4A | D. | A=B |
考点:
水的电离.
专题:
电离平衡与溶液的pH专题.
分析:
水的电离方程式为:H2O⇌H++OH﹣,水的电离过程是吸热过程,升温促进电离,加入酸或碱抑制水的电离,加入能水解的盐促进水的电离,据此即可解答.
解答:
解:依据影响水电离的因素分析,氢氧化钠溶液显碱性,抑制水的电离,在pH等于9的NaOH溶液中,c(H+)=1×10﹣9mol/L,而NaOH只能提供OH﹣,不提供H+,根据公式知:由NaOH电离产生的c(OH﹣)=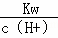 =10﹣5mol/L,则由水电离产生的c(OH﹣)=c(H+)=
=10﹣5mol/L,则由水电离产生的c(OH﹣)=c(H+)=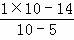 mol/L=10﹣9mol/L,即A=10﹣9mol/L;CH3COONa是弱酸强碱盐,水中乙酸根离子水解呈碱性,促进水的电离,pH=9的CH3COONa溶液促进水的电离,OH﹣全部由水电离产生,c(OH﹣)=10﹣5mol/L,即B=c(OH﹣)=10﹣5mol/L,所以:A:B=10﹣9mol/L:10﹣5mol/L=10﹣4,即A=10﹣4B.
mol/L=10﹣9mol/L,即A=10﹣9mol/L;CH3COONa是弱酸强碱盐,水中乙酸根离子水解呈碱性,促进水的电离,pH=9的CH3COONa溶液促进水的电离,OH﹣全部由水电离产生,c(OH﹣)=10﹣5mol/L,即B=c(OH﹣)=10﹣5mol/L,所以:A:B=10﹣9mol/L:10﹣5mol/L=10﹣4,即A=10﹣4B.
故选B.
点评:
本题考查了影响水的电离的因素,题目难度不大,注意碱和盐分别对水的电离平衡移动的影响是解答本题的关键.


科目:高中化学 来源: 题型:
烧杯A中盛放0.1mol•L﹣1的H2SO4溶液,烧杯B中盛放0.1mol•L﹣1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法正确的是()

A. A为电解池,B为原电池
B. Fe电极发生还原反应
C. 当A烧杯中产生0.1 mol气体,B烧杯中产生气体也为0.1mol
D. 一段时间后,B烧杯中溶液的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
中科院化学所研制的晶体材料﹣﹣纳米四氧化三铁,在核磁共振造影及医药上有广泛用途其生产过程的部分流程如下:FeCl3•6H2O FeOOH
FeOOH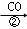 纳米四氧化三铁,下列有关叙述不合理的是()
纳米四氧化三铁,下列有关叙述不合理的是()
A. 纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当
B. 纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C. 在反应①中环丙胺的作用可能是促进氯化铁水解
D. 反应②的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
|
| A. | a mL | B. | (50﹣a)mL | C. | 大于(50﹣a)mL | D. | 大于a mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在2L的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2(g)+O2(g)⇌2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到前2min末时,容器中n(SO2)为( )
|
| A. | 1.6mol | B. | 1.2mol | C. | 大于1.6mol | D. | 小于1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
|
| A. | 生成了一种强酸弱碱盐 |
|
| B. | 弱酸溶液和强碱溶液反应 |
|
| C. | 强酸溶液和弱碱溶液反应 |
|
| D. | 一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解.
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是( )
|
| A. | 2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,则氢气的燃烧热为241.8 kJ |
|
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
|
| C. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJ/mol |
|
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2.则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
今有0.1mol/L Na2SO4溶液300mL,0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子的物质的量之比是()
A. 1:1:1 B. 3:2:2 C. 3:2:3 D. 1:1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com