
| c2(CO) |
| c(CO2) |
| c(H2)c(CO) |
| c(H2O) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c2(CO) |
| c(CO2) |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
| A、酒精灯在不使用时,必须盖上灯帽 | ||
| B、不能直接用嘴吹灭酒精灯 | ||
C、酒精少于
| ||
| D、不能用酒精灯点燃另一酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
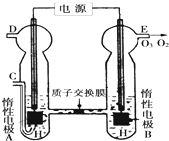 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.| pH t/min T/℃ |
3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
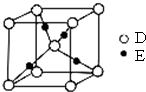 已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满.回答下列问题(用元素符号或化学式表示).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
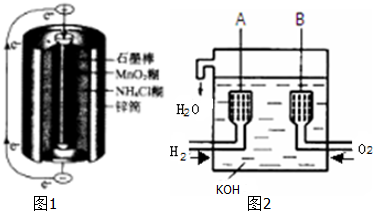
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的分馏、煤的液化以及煤的干馏等生产过程中均只发生物理变化 |
| B、分子式为C6H14的烷烃共有三种同分异构体 |
C、 属于酯类,能与NaOH溶液发生水解反应 属于酯类,能与NaOH溶液发生水解反应 |
| D、棉花、蚕丝的主要成分都是纤维素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com