
| A、氨水有弱碱性,能使湿润的红色石蕊试纸变蓝 | B、氨水是弱碱,化学式是 NH3?H2O | C、氨水中存在三种分子和四种离子 | D、氨很容易液化,液化时放热,液化后得到氨水 |


科目:高中化学 来源: 题型:阅读理解
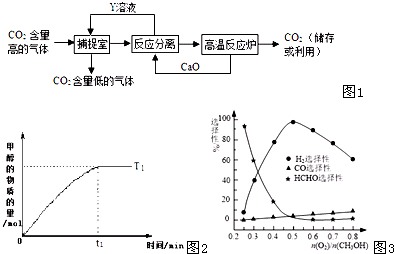
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省协作体高三第一次联考理综化学试卷(解析版) 题型:填空题
近年,为提高能利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的????????? 极(填“正”或“负”),负极反应式为??????? .用这种方法处理SO2废气的优点是????? .
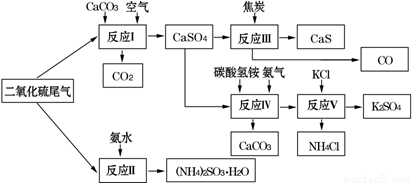
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:

①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是????????? .
②下列有关说法正确的是????????????????? (填序号)。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑
CaS+4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
③反应Ⅴ中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是????????????? .
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式??????????? .
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省襄阳市高三元月第一次调研考试理综化学试卷(解析版) 题型:填空题
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 .用这种方法处理SO2废气的优点是 .
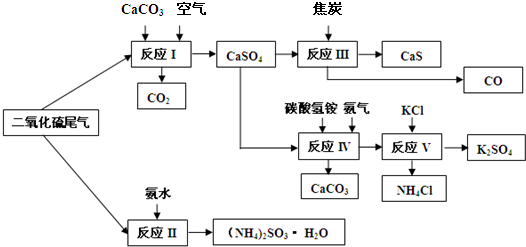
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 .
②下列有关说法正确的是 .
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑
CaS+4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
③反应Ⅴ中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是 .
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源:丰台区一模 题型:填空题
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com