
 二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
分析 (1)△H等于反应物的键能减去生成物的键能;
(2)盖斯定律:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关;
(3)总反应的平衡常数等于分反应的平衡常数之积;
(4)勒夏特列原理:如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动;
(5)催化剂不会影响化学平衡移动;
(6)可用体积分数求出各物质的浓度,然后再利用平衡常数的公式求出平衡常数.
解答 解:(1)由△H等于反应物的键能减去生成物的键能,可求得反应①的△H1=1076+2×436-343-465-3×413=-99 kJ•mol-1,故答案为:-99 kJ•mol-1;
(2)由盖斯定律可得,总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJ•mol-1;总反应的平衡常数等于分反应的平衡常数之积,则K=K12•K2•K3.
故答案为:-263 kJ•mol-1;K12•K2•K3;
(3)由勒夏特列原理,对于3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)为了提高CH3OCH3产率,反应需要向正反应方向移动,因此通过减小气体体积、降温、减少产物的量可以实现,而催化剂对化学平衡的移动没有影响,由此可知A、D正确.
故答案为:AD;
(4)反应②2CH3OH(g)?CH3OCH3(g)+H2O(g),反应③CO(g)+H2O(g)?CO2(g)+H2(g),由此可知,反应③消耗反应②中的水,根据勒夏特列原理可知,可提高CH3OCH3的产率.
故答案为:反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率;
(5)由图象可知,反应温度升高,CO的转化率降低,说明该正反应方向为放热反应,△H<0,A错误;找出p2,316℃坐标点,可知CO的转化率大于50%,B错误;由图可知,p3,316℃时,CO的转化率为50%,而此时H2和CO的物质的量之比等于系数比,即两者的转化率相等,所以H2的转化率也为50%,C正确;若增大H2和CO的物质的量之比,则平衡正向移动,CO的转化率也同时升高,D正确;根据等效平衡的原理,保持温度和压强不变,充入与起始时等比值的氢气和CO,两种平衡等效,二甲醚的体积分数不变,E错误.
故答案为:CD;
(6)设平衡时CH3OCH3的物质的量为xmol,由4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),平衡时各物质的浓度分别为:[H2]=4-2x,[CO]=2-x,[CH3OCH3]=$\frac{x}{2}$,[H2O]=$\frac{x}{2}$.二甲醚的体积分数为25%,也即$\frac{\frac{x}{2}}{(4-2x+2-x+\frac{x}{2}+\frac{x}{2})}$=$\frac{1}{4}$,解得x=$\frac{3}{2}$;所以平衡时各物质的浓度分别为:[H2]=1,[CO]=0.5,[CH3OCH3]=0.75,[H2O]=0.75,所以平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{4}({H}_{2}){c}^{2}(CO)}$=$\frac{0.75×0.75}{1×0.5×0.5}$=2.25.
故答案为:2.25.
点评 本题难度较大,综合性非常强,综合了化学平衡、转化率、盖斯定律等知识,注意知识的熟练运用和基础知识的理解,掌握基础是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 有电子转移(得失或偏移)的化学反应都是氧化还原反应 | |
| B. | p电子原子轨道的平均半径随电子层的增大而增大 | |
| C. | 电子是在原子核外,能量由低到高的不同电子层上分层排布的 | |
| D. | 氢原子电子云图中小黑点表示电子的运动轨迹 |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol/L NaOH溶液 | pH = 11 NaOH溶液 | 0.1 mol/L CH3COOH溶液 | pH = 3 CH3COOH溶液 |
下列说法正确的是( )
A.由水电离出H+的浓度c(H+):①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5
C.①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH)
D.将②与④等体积混合,若溶液pH<7,各离子浓度的关系为:
c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
将0.4 g NaOH和1.06 g Na2CO3 混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
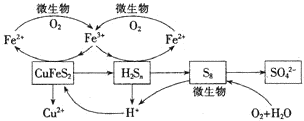 我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出.该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法.
我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出.该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度℃ | 450 | 500 | 550 | 600 |
| SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进入地下矿井中可用火把照明 | |
| B. | 实验时将水倒入浓硫酸中配置稀硫酸 | |
| C. | 节日期间,在开阔的广场燃放烟花爆竹 | |
| D. | 在实验室可以用手接触药品,用嘴吹灭酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com