
| A. | 该溶液呈碱性的原因是:C6H5O-+H2O=C6H5OH+OH- | |
| B. | 与少量CO2反应的离子方程式为:2C6H5O-+CO2+H2O=2C6H5OH+CO32- | |
| C. | 25℃时,该溶液中由水电离出的氢离子浓度大于1×10-7mol•L-1 | |
| D. | 该溶液中可能大量存在:K+、SO42-、Cl2、H+ |
分析 A.苯酚钠属于强碱弱酸盐,水解显碱性,水解为可逆反应;
B.苯酚钠与二氧化碳反应生苯酚与碳酸氢钠;
C.盐类水解促进水的电离;
D.苯氧根离子为弱酸根离子,不能与氢离子共存.
解答 解:A.苯酚钠水解的离子方程式:C6H5O-+H2O?C6H5OH+OH-,故A错误;
B.苯酚钠与二氧化碳反应生苯酚与碳酸氢钠,离子方程式:C6H5O-+CO2+H2O=C6H5OH+HCO32-,故B错误;
C.苯酚钠属于强碱弱酸盐,存在水解,使水的电离平衡向正向进行,25℃时,由水电离出的氢离子浓度大于1×10-7mol•L-1,故C正确;
D.苯氧根离子为弱酸根离子,不能与氢离子共存,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,盐类水解规律,水的电离平衡,明确苯氧根离子的性质是解题关键,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题

| A. | $\frac{8M}{{N}_{A}•{a}^{3}}$ | B. | $\frac{6M}{{N}_{A}•{a}^{3}}$ | C. | $\frac{4M}{{N}_{A}•{a}^{3}}$ | D. | $\frac{M}{{N}_{A}•{a}^{3}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 $→_{一定条件}^{Y}$
$→_{一定条件}^{Y}$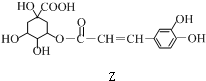
| A. | X分别与足量的Na、NaOH反应,消耗两者的物质的量之比为5﹕1 | |
| B. | Y的分子式为C9H8O3 | |
| C. | 1 mol Z与浓溴水反应最多消耗4molBr2 | |
| D. | 1 mol Z与足量NaOH溶液反应,最多消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸氢材料镧镍合金 | B. | 半导体材料砷化镓 | ||
| C. | 高温结构陶瓷材料氮化硅 | D. | 透明陶瓷材料硒化锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7:1 | B. | 7:2 | C. | 7:3 | D. | 7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:X>Y>Z | B. | 最外层电子数:Y>Z>X | ||
| C. | 原子序数:Z>Y>X | D. | 单质熔点:X>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力开发新能源和可再生能源 | |
| B. | 城市大力发展轨道交通,少开私家车 | |
| C. | 清洁燃煤、提高燃油品质 | |
| D. | 学校、家庭安装空气净化装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
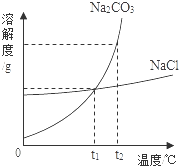 我国化学家侯德榜创立的侯氏制碱法,就是以海水晒盐得到的氯化钠为原料,制得纯碱碳酸钠,碳酸钠和氯化钠的溶解度曲线如图所示,试回答下列问题:
我国化学家侯德榜创立的侯氏制碱法,就是以海水晒盐得到的氯化钠为原料,制得纯碱碳酸钠,碳酸钠和氯化钠的溶解度曲线如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.8gN2与C2H4的混合气体中含有的电子数为1.4NA | |
| B. | 标准状况下,1.12L NO与1.12LO2的混合物中含有的原子数为0.2NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氧原子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com